题目内容
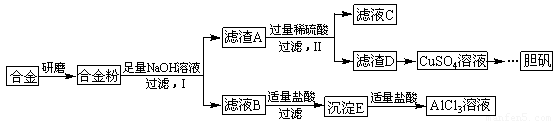
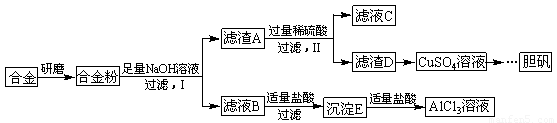
某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4?7H2O)和胆矾晶体(CuSO4?5H2O),其实验方案如图:
方案一:
试回答下列问题:
(1)过滤用的器材已有:滤纸、铁架台、铁圈、烧杯和漏斗,还要补充的玻璃仪器是
(2)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是
(3)从滤液E中得到绿矾晶体的实验操作是
(4)写出用滤渣F制备胆矾晶体的化学方程式
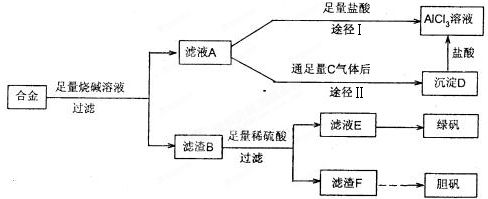
方案二:
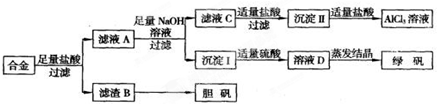
请回答下列问题:
(5)写出由滤液C到沉淀Ⅱ的离子方程式
(6)小组成员经过检测,发现制得的绿矾不纯,试分析原因
(7)方案一和方案二,你认为哪种方案相对
方案一:

试回答下列问题:
(1)过滤用的器材已有:滤纸、铁架台、铁圈、烧杯和漏斗,还要补充的玻璃仪器是
玻璃棒
玻璃棒
.(2)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是
Ⅱ
Ⅱ
,理由是按途径I直接向A加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质
按途径I直接向A加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质
.(3)从滤液E中得到绿矾晶体的实验操作是
蒸发浓缩、冷却结晶、洗涤、干燥
蒸发浓缩、冷却结晶、洗涤、干燥
.(4)写出用滤渣F制备胆矾晶体的化学方程式
2Cu+O2+2H2SO4=2CuSO4+2H2O
2Cu+O2+2H2SO4=2CuSO4+2H2O
,CuSO4+5H2O=CuSO4?5H2O
CuSO4+5H2O=CuSO4?5H2O
.方案二:

请回答下列问题:
(5)写出由滤液C到沉淀Ⅱ的离子方程式
H2O+AlO2-+H+=Al(OH)3↓
H2O+AlO2-+H+=Al(OH)3↓
.(6)小组成员经过检测,发现制得的绿矾不纯,试分析原因
亚铁离子易被氧化为三价铁离子
亚铁离子易被氧化为三价铁离子
,小组成员检测制得的绿矾不纯所用试剂为KSCN溶液
KSCN溶液
.(7)方案一和方案二,你认为哪种方案相对
方案一
方案一
更合理,理由是酸的量的控制上没有过高的要求,只需过量即可,但是方案二中,适量的酸没法控制
酸的量的控制上没有过高的要求,只需过量即可,但是方案二中,适量的酸没法控制
.分析:(1)根据过滤实验用到的仪器来回答;
(2)根据反应所得产物的组成来选择合适的制取方案;
(3)根据溶液来得到晶体来分析实验操作;
(4)根据铜、稀硫酸的性质来判断反应的发生,并结合质量守恒定律写出该反应的化学方程式;
(5)偏铝酸钠可以和少量的盐酸反应生成氢氧化铝;
(6)亚铁离子易被氧化为三价铁离子,硫氰酸钾遇到三价铁离子显示红色;
(7)根据实验中的酸和碱的量的情况来对比回答.
(2)根据反应所得产物的组成来选择合适的制取方案;
(3)根据溶液来得到晶体来分析实验操作;
(4)根据铜、稀硫酸的性质来判断反应的发生,并结合质量守恒定律写出该反应的化学方程式;
(5)偏铝酸钠可以和少量的盐酸反应生成氢氧化铝;
(6)亚铁离子易被氧化为三价铁离子,硫氰酸钾遇到三价铁离子显示红色;
(7)根据实验中的酸和碱的量的情况来对比回答.
解答:解:(1)过滤实验用到的仪器有:滤纸、铁架台、铁圈、烧杯、玻璃棒和漏斗,故答案为:玻璃棒;
(2)偏铝酸钠和过量的盐酸反应生成氯化铝和氯化钠的混合物,而向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,再用盐酸溶解,所得溶液的成分只有氯化铝,
故答案为:;途径Ⅱ更合理;因为按途径I直接向A加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质;
(3)将混合液来制备绿矾时应先将溶液加热浓缩、然后冷却结晶,将析出的固体洗涤、干燥,即可得到绿矾,故答案为:蒸发浓缩、冷却结晶、洗涤、干燥;
(4)铜不能和稀硫酸反应,但是当加热并通入空气之后,铜和氧气反应生成氧化铜,然后氧化铜会和硫酸反应生成硫酸铜,硫酸铜溶液是蓝色的,由于各反应物是混合接触在一起的,这两个反应是同时进行的,所以氧化铜没机会单独的存在,故我们可以认为反应物为氧气、铜和硫酸,而生成物为硫酸铜和水,
故可以写出该反应的化学方程式2Cu+O2+2H2SO4=2CuSO4+2H2O;CuSO4+5H2O=CuSO4?5H2O,
故答案为:2Cu+O2+2H2SO4=2CuSO4+2H2O;CuSO4+5H2O=CuSO4?5H2O;
(5)偏铝酸钠和盐酸反应的实质是:H2O+AlO2-+H+=Al(OH)3↓,故答案为:H2O+AlO2-+H+=Al(OH)3↓;
(6)因为硫酸亚铁中的亚铁离子易被氧化为三价铁离子,会导致绿矾晶体不纯,三价铁的检验用硫氰酸钾溶液,会变红色,故答案为:亚铁离子易被氧化为三价铁离子;KSCN溶液;
(6)在实验方案一中,酸的量的控制上没有过高的要求,只需过量即可,但是方案二中,需要的是适量的酸,这很难控,故答案为:方案一;酸的量的控制上没有过高的要求,只需过量即可,但是方案二中,适量的酸没法控制.
(2)偏铝酸钠和过量的盐酸反应生成氯化铝和氯化钠的混合物,而向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,再用盐酸溶解,所得溶液的成分只有氯化铝,
故答案为:;途径Ⅱ更合理;因为按途径I直接向A加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质;
(3)将混合液来制备绿矾时应先将溶液加热浓缩、然后冷却结晶,将析出的固体洗涤、干燥,即可得到绿矾,故答案为:蒸发浓缩、冷却结晶、洗涤、干燥;
(4)铜不能和稀硫酸反应,但是当加热并通入空气之后,铜和氧气反应生成氧化铜,然后氧化铜会和硫酸反应生成硫酸铜,硫酸铜溶液是蓝色的,由于各反应物是混合接触在一起的,这两个反应是同时进行的,所以氧化铜没机会单独的存在,故我们可以认为反应物为氧气、铜和硫酸,而生成物为硫酸铜和水,
故可以写出该反应的化学方程式2Cu+O2+2H2SO4=2CuSO4+2H2O;CuSO4+5H2O=CuSO4?5H2O,
故答案为:2Cu+O2+2H2SO4=2CuSO4+2H2O;CuSO4+5H2O=CuSO4?5H2O;
(5)偏铝酸钠和盐酸反应的实质是:H2O+AlO2-+H+=Al(OH)3↓,故答案为:H2O+AlO2-+H+=Al(OH)3↓;
(6)因为硫酸亚铁中的亚铁离子易被氧化为三价铁离子,会导致绿矾晶体不纯,三价铁的检验用硫氰酸钾溶液,会变红色,故答案为:亚铁离子易被氧化为三价铁离子;KSCN溶液;
(6)在实验方案一中,酸的量的控制上没有过高的要求,只需过量即可,但是方案二中,需要的是适量的酸,这很难控,故答案为:方案一;酸的量的控制上没有过高的要求,只需过量即可,但是方案二中,适量的酸没法控制.
点评:本题是对物质的分离和提纯知识点的考查,题目难度不是很大,可以根据所学的知识进行.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目