摘要:元素周期表 (1)结构 第1周期: 种元素 三个短周期 第2周期: 种元素 第3周期: 种元素 周期 第4周期: 种元素 三个长周期 第5周期: 种元素 第6周期: 种元素 一个不完全周期:第7周期 个主族:ⅠA 族-ⅦA族 个副族:ⅠB族-ⅦB族 族 :Fe.Co.Ni等9种元素 :He.Ne.Ar等6种元素 (2)应用 ① 预测元素的性质:常见的题目是给出一种不常见的主族元素(如砹.碲.铋.铅.铟.镭.铯等).或尚未发现的主族元素.推测该元素及其单质或化合物所具有的性质.解答的关键是根据该元素所在族的其它元素的性质.找出递变规律加以推测. ② 启发人们在一定区域内寻找物质.
网址:http://m.1010jiajiao.com/timu3_id_60313[举报]
①②③④⑤⑥六种元素,在元素周期表中的位置如图所示.回答下列问题:
(1)六种元素中,金属性最强的元素位置位于元素周期表
(2)元素①和②可以形成众多的化合物,其中最简单的是(写电子式)
 ,与该化合物电子总数相同的三原子分子的结构式为
,与该化合物电子总数相同的三原子分子的结构式为
(3)画出元素③的原子结构示意图
 ,该元素形成的气态氢化物通常极易溶解于水,其原因是
,该元素形成的气态氢化物通常极易溶解于水,其原因是
(4)写出元素④、⑥的最高价氧化物对应水化物相互反应的离子方程式为
查看习题详情和答案>>
| ⅠA | 0 | |||||||
| ① | ⅡA | … | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| ② | ③ | |||||||
| ④ | ⑤ | ⑥ |
第三周期ⅠA族
第三周期ⅠA族
,该元素的单质与水反应的离子方程式为2H2O+2Na═2Na++2OH-+H2↑
2H2O+2Na═2Na++2OH-+H2↑
.(2)元素①和②可以形成众多的化合物,其中最简单的是(写电子式)


H-O-H
H-O-H
.(3)画出元素③的原子结构示意图


NH3是极性分子,能与水反应,与水分子能形成氢键
NH3是极性分子,能与水反应,与水分子能形成氢键
.(4)写出元素④、⑥的最高价氧化物对应水化物相互反应的离子方程式为
H++OH-═H2O
H++OH-═H2O
.元素周期表是学习物质结构与性质的重要工具.下表是元素周期表的一部分,表中所列字母A、B、D、E、G、H、Q、M、R分别代表某一化学元素.请用所给元素回答下列问题.
(1)Q元素在元素周期表中的位置

(2)E、Q、R三种元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)
(3)M、D两元素形成的化合物中含有的化学键类型是
(4)用表中所给元素组成反应物,用化学方程式说明元素Q和R非金属性的强弱:
查看习题详情和答案>>
| A | ||||||||||||||||||
| M | B | D | ||||||||||||||||
| G | H | Q | R | |||||||||||||||
| E | ||||||||||||||||||
第三周期ⅥA族
第三周期ⅥA族
,E元素原子结构示意图为

(2)E、Q、R三种元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)
S2->Cl->K+
S2->Cl->K+
.(3)M、D两元素形成的化合物中含有的化学键类型是
共价键
共价键
,其MD2分子的结构式:O=C=O
O=C=O
.(4)用表中所给元素组成反应物,用化学方程式说明元素Q和R非金属性的强弱:
H2S+C12=2HC1+S
H2S+C12=2HC1+S
;元素G、H的金属性强弱:2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
.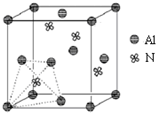 元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、磷化硼和砷化镓属于此列,如氮化铝晶体中每个Al原子与4个N原子相连,每个N原子也与4个Al原子相连,晶胞如右图所示.磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层;砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%.试回答下列问题:
元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、磷化硼和砷化镓属于此列,如氮化铝晶体中每个Al原子与4个N原子相连,每个N原子也与4个Al原子相连,晶胞如右图所示.磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层;砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%.试回答下列问题:(1)下列离子中最外层电子数不为8的是
D
D
(选填序号).A.P3- B.Al3+ C.Ti4+ D.Ga3+
(2)下列说法正确的是
BC
BC
(选填序号).A.硼和镓都属于S区元素,磷、砷属于P区元素
B.第一电离能:As>Ga Mg>Al
C.根据等电子体原理,砷化镓、磷化硼的晶胞与氮化铝晶体相同且类似于单晶硅
D.NH3沸点高于AsH3,其原因是NH3分子中共价键强度较大
(3)砷化镓可由(CH3)3Ga和AsH3反应得到,该反应在700℃进行,反应的化学方程式为
(CH3)3Ga+AsH3
GaAs+3CH4
| 700℃ |
(CH3)3Ga+AsH3
GaAs+3CH4
;| 700℃ |
下列有机分子中碳原子的杂化方式与(CH3)3Ga分子中Ga原子的杂化方式相同的是
BDE
BDE
.(填序号)A.CH4B.CH2=CH2C.CH≡CH D.HCHO E.

(4)请画出三溴化磷分子的路易斯结构式


非极性
非极性
(填“极性”“非极性”)分子.元素周期律和元素周期表对深化物质性质的认识具有重要的作用,有利于将零乱的元素化合物知识整合起来形成知识网络.某同学整理了关于氯元素的相关知识,请你补充完整.
(1)氯元素的原子结构示意图为
 ,在周期表中的位置为
,在周期表中的位置为
(2)氯、硫、磷三种元素对应的气态氢化物中,稳定性由强到弱的顺序为
(3)含有氯元素的常见物质转化关系如图: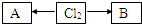 ,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式
,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式
查看习题详情和答案>>
(1)氯元素的原子结构示意图为


第三周期、第ⅦA族
第三周期、第ⅦA族
.(2)氯、硫、磷三种元素对应的气态氢化物中,稳定性由强到弱的顺序为
HCl>H2S>PH3
HCl>H2S>PH3
,氯、溴两种元素的单质中,氧化性强的是Cl2
Cl2
,设计简单的实验方案证明取少量NaBr(HBr)溶液,向其中通入氯气,溶液变为橙色,则证明Cl2的氧化性强于Br2
取少量NaBr(HBr)溶液,向其中通入氯气,溶液变为橙色,则证明Cl2的氧化性强于Br2
.(3)含有氯元素的常见物质转化关系如图:
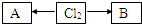 ,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式
,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O
| ||
4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O
;C与B的组成元素相同,C中氯元素的化合价为最高价,C与H2SO4相比,酸性强的是
| ||
HClO4
HClO4
(填化学式). 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.(1)下列叙述正确的是
AD
AD
.(填字母)A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个?键和1个大π键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
3d54s2
3d54s2
,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态,而Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态.
Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态,而Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态.
.(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于
d区
d区
区.(4)Ti的一种氧化物X,其晶胞结构如上图所示,则X的化学式为
TiO2
TiO2
.(5)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2.
①H、C、N、O四种元素的电负性由小到大的顺序为
H<C<N<O
H<C<N<O
.②与CNO-互为等电子体微粒的化学式为
CO2
CO2
(写出一种即可).③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式
N≡C-O-H
N≡C-O-H
.