题目内容
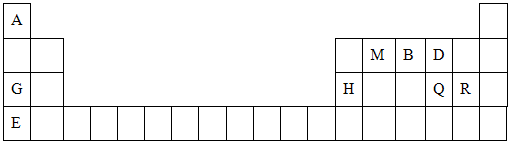
元素周期表是学习物质结构与性质的重要工具.下表是元素周期表的一部分,表中所列字母A、B、D、E、G、H、Q、M、R分别代表某一化学元素.请用所给元素回答下列问题.
(1)Q元素在元素周期表中的位置

(2)E、Q、R三种元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)
(3)M、D两元素形成的化合物中含有的化学键类型是
(4)用表中所给元素组成反应物,用化学方程式说明元素Q和R非金属性的强弱:
| A | ||||||||||||||||||
| M | B | D | ||||||||||||||||
| G | H | Q | R | |||||||||||||||
| E | ||||||||||||||||||
第三周期ⅥA族
第三周期ⅥA族
,E元素原子结构示意图为

(2)E、Q、R三种元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)
S2->Cl->K+
S2->Cl->K+
.(3)M、D两元素形成的化合物中含有的化学键类型是
共价键
共价键
,其MD2分子的结构式:O=C=O
O=C=O
.(4)用表中所给元素组成反应物,用化学方程式说明元素Q和R非金属性的强弱:
H2S+C12=2HC1+S
H2S+C12=2HC1+S
;元素G、H的金属性强弱:2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
.分析:(1)根据元素在周期表中的位置和原子结构示意图的画法来回答;
(2)核外电子排布相同的离子,则核电荷数越大半径越小;
(3)碳和氧元素之间可以形成化合物一氧化塔和二氧化碳,根据成键元素确定化学键类型,根据二氧化碳的结构来确定结构式;
(4)非金属强的单质能置换非金属性弱的单质,根据单质和水反应置换氢气的难易可以判断金属性的强弱.
(2)核外电子排布相同的离子,则核电荷数越大半径越小;
(3)碳和氧元素之间可以形成化合物一氧化塔和二氧化碳,根据成键元素确定化学键类型,根据二氧化碳的结构来确定结构式;
(4)非金属强的单质能置换非金属性弱的单质,根据单质和水反应置换氢气的难易可以判断金属性的强弱.
解答:解:根据元素正在周期表中的分布,可以确定A是H,M是C,B是N,D是O,G是Na,H是Al,Q是S,R是Cl,E是K.
(1)S元素位于第三周期ⅥA族,原子结构示意图为: ,故答案为:第三周期ⅥA族;
,故答案为:第三周期ⅥA族; ;
;
(2))K、S、Cl三种元素的原子形成与Ar具有相同电子层结构的简单离子具有相同的核外电子排布,核电荷数越多半径越大,即S2->Cl->K+,故答案为:S2->Cl->K+;
(3)C、O两元素形成的化合物一氧化碳和二氧化碳中含有的化学键类型均是共价键,二氧化碳中碳和氧原子间形成的是共价双键,结构式为:O=C=O,故答案为:共价键;O=C=O;
(4)非金属强的单质氯气能置换非金属性弱的单质S,即H2S+C12=2HCl+S,单质钠和水反应置换出氢气
2Na+2H2O=2NaOH+H2↑,但是金属铝和水不反应,证明钠的金属性强于金属铝,
故答案为:H2S+C12=2HC1+S;2Na+2H2O=2NaOH+H2↑.
(1)S元素位于第三周期ⅥA族,原子结构示意图为:
 ,故答案为:第三周期ⅥA族;
,故答案为:第三周期ⅥA族; ;
;(2))K、S、Cl三种元素的原子形成与Ar具有相同电子层结构的简单离子具有相同的核外电子排布,核电荷数越多半径越大,即S2->Cl->K+,故答案为:S2->Cl->K+;
(3)C、O两元素形成的化合物一氧化碳和二氧化碳中含有的化学键类型均是共价键,二氧化碳中碳和氧原子间形成的是共价双键,结构式为:O=C=O,故答案为:共价键;O=C=O;
(4)非金属强的单质氯气能置换非金属性弱的单质S,即H2S+C12=2HCl+S,单质钠和水反应置换出氢气
2Na+2H2O=2NaOH+H2↑,但是金属铝和水不反应,证明钠的金属性强于金属铝,
故答案为:H2S+C12=2HC1+S;2Na+2H2O=2NaOH+H2↑.
点评:本题考查学生元素元素周期表的结构和周期律的应用知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
元素周期表是学习物质结构和性质的重要工具,元素周期律反映了元素性质的周期性变化规律。
(1)元素A的原子最外层电子排布式为nsnnpn,该原子最外层共有 种不同运动状态的电子,该原子核外共有 种能量不同的电子。元素A与氢元素形成的分子,其空间结构可能是(填序号) 。
(2)下列变化规律中正确的是 。
A.金属K、Na、Mg的熔沸点由低到高
B.C1-、Br-、I-的失电子能力由弱到强
C.H+、Li+、H-的半径由大到小
D.H3PO4、HClO4、H2SO4的酸性由弱到强
(3)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中A的电子式为 ,E的化学式为 。
|
氢化物 |
A |
B |
HF |
D |
E |
|
沸点/℃ |
1317 |
100 |
19.5 |
33 |
164 |