题目内容
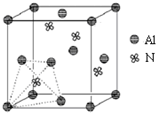 元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、磷化硼和砷化镓属于此列,如氮化铝晶体中每个Al原子与4个N原子相连,每个N原子也与4个Al原子相连,晶胞如右图所示.磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层;砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%.试回答下列问题:
元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、磷化硼和砷化镓属于此列,如氮化铝晶体中每个Al原子与4个N原子相连,每个N原子也与4个Al原子相连,晶胞如右图所示.磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层;砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%.试回答下列问题:(1)下列离子中最外层电子数不为8的是
D
D
(选填序号).A.P3- B.Al3+ C.Ti4+ D.Ga3+
(2)下列说法正确的是
BC
BC
(选填序号).A.硼和镓都属于S区元素,磷、砷属于P区元素
B.第一电离能:As>Ga Mg>Al
C.根据等电子体原理,砷化镓、磷化硼的晶胞与氮化铝晶体相同且类似于单晶硅
D.NH3沸点高于AsH3,其原因是NH3分子中共价键强度较大
(3)砷化镓可由(CH3)3Ga和AsH3反应得到,该反应在700℃进行,反应的化学方程式为
(CH3)3Ga+AsH3
GaAs+3CH4
| 700℃ |
(CH3)3Ga+AsH3
GaAs+3CH4
;| 700℃ |
下列有机分子中碳原子的杂化方式与(CH3)3Ga分子中Ga原子的杂化方式相同的是
BDE
BDE
.(填序号)A.CH4B.CH2=CH2C.CH≡CH D.HCHO E.

(4)请画出三溴化磷分子的路易斯结构式


非极性
非极性
(填“极性”“非极性”)分子.分析:(1)根据其基态离子核外电子排布式判断;
(2)A.根据元素周期表知,硼、镓、磷、砷都属于P区元素;
B.同一周期第一电离能:第VA族大于第IIIA族,第IIA族大于第IIIA族;
C.等电子体结构相似;
D.含有氢键的物质沸点较大;
(3)根据温度、反应物和生成物结合原子守恒写出反应方程式,根据价层电子对互斥理论确定杂化方式;
(4)人们把这类(用短线表示共价键,同时用小黑点表示非键合的孤电子对)添加了孤对电子的结构式叫做路易斯结构式,也叫电子结构式;
根据三溴化硼的空间构型判断分子的极性,如果是对称结构则是非极性分子,否则是极性分子.
(2)A.根据元素周期表知,硼、镓、磷、砷都属于P区元素;
B.同一周期第一电离能:第VA族大于第IIIA族,第IIA族大于第IIIA族;
C.等电子体结构相似;
D.含有氢键的物质沸点较大;
(3)根据温度、反应物和生成物结合原子守恒写出反应方程式,根据价层电子对互斥理论确定杂化方式;
(4)人们把这类(用短线表示共价键,同时用小黑点表示非键合的孤电子对)添加了孤对电子的结构式叫做路易斯结构式,也叫电子结构式;
根据三溴化硼的空间构型判断分子的极性,如果是对称结构则是非极性分子,否则是极性分子.
解答:解:(1)A.P3-核外有3个电子层,最外层有8个电子,故不选;
B.Al3+核外有2个电子层,最外层有8个电子,故不选;
C.Ti4+核外有18个电子,最外层有8个电子,故不选;
D.Ga3+核外有28个电子,最外层有18个电子,故选;
故选D;
(2)A.除了ds区外,区的名称来自按构造原理最后填入电子的能级的符号,所以硼、镓、磷、砷都属于P区元素,故错误;
B.同一周期第一电离能:第VA族大于第IIIA族,第IIA族大于第IIIA族,所以As>Ga、Mg>Al,故正确;
C.等电子体结构相似,所以砷化镓、磷化硼的晶胞与氮化铝晶体相同且类似于单晶硅,故正确;
D.含有氢键的物质沸点较大,氨气中存在氢键,AsH3中不含氢键,所以NH3沸点高于AsH3,故错误;
故选BC;
(3)在700℃时,(CH3)3Ga和AsH3反应生成GaAs和甲烷,反应方程式为:(CH3)3Ga+AsH3
GaAs+3CH4,(CH3)3Ga分子中Ga原子含有3个σ键且不含孤电子对,所以Ga原子的杂化方式是sp2,
A.CH4中碳原子含有4个σ键且不含孤电子对,所以采用sp3杂化,故不选;
B.CH2=CH2中碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,故选;
C.CH≡CH中碳原子含有2个σ键且不含孤电子对,所以采用sp杂化,故不选;
D.HCHO 中碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,故选;
E. 中碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,故选;
中碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,故选;
故答案为:(CH3)3Ga+AsH3
GaAs+3CH4,BDE;
(4)三溴化磷分子的路易斯结构式为: ,三溴化硼分子中B原子价层电子对=3+
,三溴化硼分子中B原子价层电子对=3+
(3-3×1)=3,且不含孤电子对,所以是平面正三角形结构,属于对称结构,正负电荷重心重合,属于非极性分子,故答案为: ,非极性.
,非极性.
B.Al3+核外有2个电子层,最外层有8个电子,故不选;
C.Ti4+核外有18个电子,最外层有8个电子,故不选;
D.Ga3+核外有28个电子,最外层有18个电子,故选;
故选D;
(2)A.除了ds区外,区的名称来自按构造原理最后填入电子的能级的符号,所以硼、镓、磷、砷都属于P区元素,故错误;
B.同一周期第一电离能:第VA族大于第IIIA族,第IIA族大于第IIIA族,所以As>Ga、Mg>Al,故正确;
C.等电子体结构相似,所以砷化镓、磷化硼的晶胞与氮化铝晶体相同且类似于单晶硅,故正确;
D.含有氢键的物质沸点较大,氨气中存在氢键,AsH3中不含氢键,所以NH3沸点高于AsH3,故错误;
故选BC;
(3)在700℃时,(CH3)3Ga和AsH3反应生成GaAs和甲烷,反应方程式为:(CH3)3Ga+AsH3
| 700℃ |
A.CH4中碳原子含有4个σ键且不含孤电子对,所以采用sp3杂化,故不选;
B.CH2=CH2中碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,故选;
C.CH≡CH中碳原子含有2个σ键且不含孤电子对,所以采用sp杂化,故不选;
D.HCHO 中碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,故选;
E.
 中碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,故选;
中碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,故选;故答案为:(CH3)3Ga+AsH3
| 700℃ |
(4)三溴化磷分子的路易斯结构式为:
 ,三溴化硼分子中B原子价层电子对=3+
,三溴化硼分子中B原子价层电子对=3+| 1 |
| 2 |
 ,非极性.
,非极性.点评:本题考查较综合,涉及杂化方式的判断、第一电离能的大小判断等知识点,难点是路易斯结构式的书写,该知识点不属于中学知识,注意第一电离能的规律及异常现象,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
