摘要:25.答案: (1)Zn, 正极. (2)锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀, b. (3)2H++2e- = H2, 87 g. [解析](1)还原性较强的Zn作负极.失电子有负极经外电路流向正极. (2)除杂原则是:加入物要过量.不能引入新杂质.故选Zn将Cu2+置换而除去. (3)阴极上.阳离子得电子.Mn2+和H+比较.应是H+得电子. 由关系式知:MnSO4-MnO2-2e-.通过2 mol电子产生1 mol MnO2.即87 g.
网址:http://m.1010jiajiao.com/timu3_id_59941[举报]
日常用的电池为锌锰干电池,其电极分别为碳棒和锌壳,以糊状NH4Cl作电解质(其中加入MnO2氧化吸收H2),电极反应式为:Zn-2e-═Zn2+;2NH4++2e-═2NH3+H2.根据叙述试判断下列说法中正确的是( )
查看习题详情和答案>>
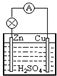 在如图所示的原电池中,下列说法正确的是( )
在如图所示的原电池中,下列说法正确的是( )