摘要:11.[化学--选修物质结构与性质] (1)S C (2)V形 直线形 SO2 因为CO2是非极性分子.SO2和H2O都是极性分子.根据“相似相溶 原理.SO2在H2O中的溶解度较大 (3)Cr 四 1s22s22p63s23p63d54s1 +6 (4)F-H-F F-H-O O-H-F O-H-O [解析]根据电子的核外排布规律.能量最低原理.且X原子核外的M层中只有两对成对电子.故X为硫元素.Y原子核外的L层电子数是K层的两倍.共有6个电子.Y为碳元素.Z是地壳内含量最高的元素为氧元素.Q的核电荷数是X与Z的核电荷数之和.Q的核电荷数为24.是铬元素.在元素周期表的各元素中电负性最大的是氟元素.XZ2与YZ2分子为SO2.CO2. SO2和H2O都是极性分子.根据“相似相溶 原理.SO2在H2O中的溶解度较大.且H易与O. F.N形成氢键.
网址:http://m.1010jiajiao.com/timu3_id_59554[举报]
[化学--选修物质结构与性质]
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+离子M层3d轨道电子为半满状态.请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出F原子的电子排布式
(2)A、B、C的第一电离能由小到大的顺序为
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难.对此,你的解释是
(4)已知F晶体的堆积方式与金属钾相同,则F晶胞中F原子的配位数为
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因
查看习题详情和答案>>
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+离子M层3d轨道电子为半满状态.请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出F原子的电子排布式
1s22s22p63s23p63d64s2
1s22s22p63s23p63d64s2
,F位于周期表d
d
区.(2)A、B、C的第一电离能由小到大的顺序为
N>O>C
N>O>C
.(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
| 元 素 | M | F | |
| 电能 (kJ?mol-1) |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
Mn2+的3d轨道电子排布为半满状态较稳定
Mn2+的3d轨道电子排布为半满状态较稳定
、而Fe2+的3d轨道电子数为6,不是较稳定状态
而Fe2+的3d轨道电子数为6,不是较稳定状态
;(4)已知F晶体的堆积方式与金属钾相同,则F晶胞中F原子的配位数为
8
8
,一个晶胞中F原子的数目为2
2
.(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
氧元素电负性很强,H2O2分子间存在氢键,所以熔沸点比H2S高,H2O2分子与水分子可形成氢键,所以与任意比互溶
氧元素电负性很强,H2O2分子间存在氢键,所以熔沸点比H2S高,H2O2分子与水分子可形成氢键,所以与任意比互溶
. (2011?郑州二模)[化学--选修物质结构与性质]
(2011?郑州二模)[化学--选修物质结构与性质]已知A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次增大.B、C、D同周期,A、D同主族,B,C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.E元素的原子核外共有20种不同运动状态的电子,且E的原子序数比D大4.
(1)B、C的第一电离能较大的是
Al
Al
(填元素符号).(2)A的氢化物的分子空间构型为
V型或折线型
V型或折线型
,其中心原子采取sp3
sp3
杂化.(3)A和D的氢化物中,沸点较高的是
H2O
H2O
(填化学式),其原因是水分子之间可以形成氢键,而H2S分子之间不能形成氢键
水分子之间可以形成氢键,而H2S分子之间不能形成氢键
.(4)仅由A与B元素组成,且含有非极性键的化合物是
Na2O2
Na2O2
(填化学式).(5)E的核外电子排布式是
1S22S22P63S23P64S2
1S22S22P63S23P64S2
.(6)B的最高价氧化物对应的水化物,其溶液与C单质反应的化学方程式是
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑或2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑或2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.(7)E单质在A单质中燃烧时得到一种白色晶体,其晶体的晶胞结构如右图所示,则该晶体的化学式为
CaO2
CaO2
. (2011?新余二模)化学--选修物质结构与性质
(2011?新余二模)化学--选修物质结构与性质已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为
Na<Al<Si<N
Na<Al<Si<N
.(用元素符号表示)(2)B的氯化物的熔点比D的氯化物的熔点
高
高
(填高或低),理由是NaCl为离子晶体而SiCl4为分子晶体
NaCl为离子晶体而SiCl4为分子晶体
.(3)E的最高价氧化物分子的空间构型是
平面正三角形
平面正三角形
.(4)F的核外电子排布式是
1s22s22p63s23p63d104s1(或[Ar]3d104s1)
1s22s22p63s23p63d104s1(或[Ar]3d104s1)
,F的高价离子与A的简单氢化物形成的配离子的化学式为[Cu(NH3)4]2+
[Cu(NH3)4]2+
.(5)A、F形成某种化合物的晶胞结构如图所示,则其化学式为
Cu3 N
Cu3 N
;(黑色球表示F原子)(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,其晶体中所含的化学键类型为
共价键
共价键
.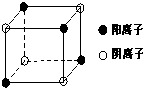 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.(1)A、B、C、D、E元素最高价氧化物对应水化物的酸性由强到弱的顺序为(用化学式表示)
(2)E元素的常见阴离子的核外电子排布式为
(3)右图是E和Fe形成的晶体FeE2的最小单元“晶胞”,FeE2晶体中阴、阳离子数之比为
【化学-选修物质结构与性质】
X、Y、Z、Q、E、F六种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在第二周期主族元素中电负性最大的元素.
请回答下列问题:
(1)XZ2与YZ2分子的立体结构分别是
(2)Q的元素符号是
(3)用氢键表示式写出E的氢化物溶液中存在的所有氢键
(4)F的氢化物是一种碱性气体,F还可与氢形成离子化合物FH5,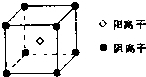 其电子式为
其电子式为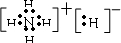
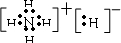 ;其晶体的最小结构单元如图所示经实验测得CA5晶体的密度为dg/cm3,阿伏加德罗常数用NA表示,则该晶体中阴离子与阳离子之间的最短距离为
;其晶体的最小结构单元如图所示经实验测得CA5晶体的密度为dg/cm3,阿伏加德罗常数用NA表示,则该晶体中阴离子与阳离子之间的最短距离为
cm.
查看习题详情和答案>>
X、Y、Z、Q、E、F六种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在第二周期主族元素中电负性最大的元素.
请回答下列问题:
(1)XZ2与YZ2分子的立体结构分别是
V形
V形
和直线形
直线形
,相同条件下两者在水中的溶解度较大的是SO2
SO2
(写分子式),理由是因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大
因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大
;(2)Q的元素符号是
Cr
Cr
,它的核外电子排布式为1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
,在形成化合物时它的最高化合价为+6
+6
;(3)用氢键表示式写出E的氢化物溶液中存在的所有氢键
F-H…FF-H…O O-H…F O-H…O
F-H…FF-H…O O-H…F O-H…O
.(4)F的氢化物是一种碱性气体,F还可与氢形成离子化合物FH5,
 其电子式为
其电子式为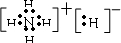
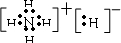
| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||