题目内容
【化学-选修物质结构与性质】
X、Y、Z、Q、E、F六种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在第二周期主族元素中电负性最大的元素.
请回答下列问题:
(1)XZ2与YZ2分子的立体结构分别是
(2)Q的元素符号是
(3)用氢键表示式写出E的氢化物溶液中存在的所有氢键
(4)F的氢化物是一种碱性气体,F还可与氢形成离子化合物FH5, 其电子式为
其电子式为
 ;其晶体的最小结构单元如图所示经实验测得CA5晶体的密度为dg/cm3,阿伏加德罗常数用NA表示,则该晶体中阴离子与阳离子之间的最短距离为
;其晶体的最小结构单元如图所示经实验测得CA5晶体的密度为dg/cm3,阿伏加德罗常数用NA表示,则该晶体中阴离子与阳离子之间的最短距离为
cm.
X、Y、Z、Q、E、F六种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在第二周期主族元素中电负性最大的元素.
请回答下列问题:
(1)XZ2与YZ2分子的立体结构分别是
V形
V形
和直线形
直线形
,相同条件下两者在水中的溶解度较大的是SO2
SO2
(写分子式),理由是因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大
因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大
;(2)Q的元素符号是
Cr
Cr
,它的核外电子排布式为1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
,在形成化合物时它的最高化合价为+6
+6
;(3)用氢键表示式写出E的氢化物溶液中存在的所有氢键
F-H…FF-H…O O-H…F O-H…O
F-H…FF-H…O O-H…F O-H…O
.(4)F的氢化物是一种碱性气体,F还可与氢形成离子化合物FH5,
 其电子式为
其电子式为

| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||
分析:根据电子的核外排布规律,能量最低原理,且X原子核外的M层中只有两对成对电子,电子排布式为1s22s22p63s23p4,故X为硫元素,Y原子核外的L层电子数是K层的两倍,共有6个电子,Y为碳元素,Z是地壳内含量(质量分数)最高的元素为氧元素,Q的核电荷数是X与Z的核电荷数之和,Q的核电荷数为24,是铬元素,在元素周期表的各元素中电负性最大的是氟元素,即E为F元素,XZ2与YZ2分子为SO2、CO2,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大,且H易与O、F、N形成氢键.
F与氢形成离子化合物FH5,应为NH4H,为离子化合物,晶胞中含有一个“NH4H分子”,设晶胞的边长为acm,则有
=d,a=
d,晶体中阴离子与阳离子之间的最短距离为顶点和体心的距离,为
× a=
.
F与氢形成离子化合物FH5,应为NH4H,为离子化合物,晶胞中含有一个“NH4H分子”,设晶胞的边长为acm,则有
| ||
| a3 |
| 3 |
| ||
| ||
| 2 |
| ||
| 2 |
| 3 |
| ||
解答:解:根据电子的核外排布规律,能量最低原理,且X原子核外的M层中只有两对成对电子,电子排布式为1s22s22p63s23p4,故X为硫元素,Y原子核外的L层电子数是K层的两倍,共有6个电子,Y为碳元素,Z是地壳内含量(质量分数)最高的元素为氧元素,Q的核电荷数是X与Z的核电荷数之和,Q的核电荷数为24,是铬元素,在元素周期表的各元素中电负性最大的是氟元素,即E为F元素,
(1)XZ2与YZ2分子为SO2、CO2,SO2的价层电子对为3,其中孤电子对为
=1,SO2含有2个δ键,分子的立体构型为V形,CO2的价层电子对为2,含有2个δ键,分子的立体构型为直线形,CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大,
故答案为:V形;直线形;SO2;因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大;
(2)Q的核电荷数为24,是铬元素,根据电子的核外排布规律,能量最低原理,,电子排布式为1s22s22p63s23p63d54s1,价层电子数位6,所以最高正价为+6价,
故答案为:Cr;1s22s22p63s23p63d54s1;+6;
(3)在HF的溶液中,含有氢键,其中F与H,O与H之间形成氢键,可表示为F-H…F,F-H…O,O-H…F,O-H…O,
故答案为:F-H…F,F-H…O,O-H…F,O-H…O;
(4)F的氢化物是一种碱性气体,应为NH3,则F为N元素,F还可与氢形成离子化合物FH5,则应为NH4H,为离子化合物,电子式为 ,
,
晶胞中含有的阳离子个数为1,阴离子个数为8×
=1,即晶胞中含有一个“NH4H分子”,设晶胞的边长为acm,则有
=d,a=
d,晶体中阴离子与阳离子之间的最短距离为顶点和体心的距离,为
× a=
,
故答案为: ;
;
.
(1)XZ2与YZ2分子为SO2、CO2,SO2的价层电子对为3,其中孤电子对为
| 6-2×2 |
| 2 |
故答案为:V形;直线形;SO2;因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大;
(2)Q的核电荷数为24,是铬元素,根据电子的核外排布规律,能量最低原理,,电子排布式为1s22s22p63s23p63d54s1,价层电子数位6,所以最高正价为+6价,
故答案为:Cr;1s22s22p63s23p63d54s1;+6;
(3)在HF的溶液中,含有氢键,其中F与H,O与H之间形成氢键,可表示为F-H…F,F-H…O,O-H…F,O-H…O,
故答案为:F-H…F,F-H…O,O-H…F,O-H…O;
(4)F的氢化物是一种碱性气体,应为NH3,则F为N元素,F还可与氢形成离子化合物FH5,则应为NH4H,为离子化合物,电子式为
 ,
,晶胞中含有的阳离子个数为1,阴离子个数为8×
| 1 |
| 8 |
| ||
| a3 |
| 3 |
| ||
| ||
| 2 |
| ||
| 2 |
| 3 |
| ||
故答案为:
 ;
;
| ||
| 2 |
| 3 |
| ||
点评:本题考查较为综合,涉及原子结构与元素周期律知识以及晶胞的计算、氢键等知识,题目难度较大,注意利用均摊法判断晶胞问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 【化学--选修物质结构与性质】
【化学--选修物质结构与性质】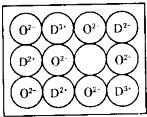 【化学-选修物质结构与性质】
【化学-选修物质结构与性质】