题目内容
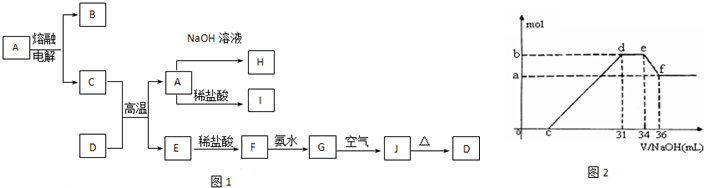
A-J是中学化学中常见的物质,它们之间的转化关系如框图1所示(部分产物已略去).已知A是一种高熔点物质,J是一种红褐色沉淀.请回答下列问题:
(1)A的化学式为
(2)H溶液中通入过量的CO2,其反应的离子方程式是
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因
(4)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的C、E混合物 与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
①图2中oc段没有沉淀生成,此阶段发生反应的离子方程式为
②在de段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式
上述现象说明溶液中
③b与a的差值为
(1)A的化学式为
Al2O3
Al2O3
(2)H溶液中通入过量的CO2,其反应的离子方程式是
[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-
[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-
G→J的化学方程式为4Fe(OH)2+2H2O+O2═4Fe(OH)3
4Fe(OH)2+2H2O+O2═4Fe(OH)3
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因
Fe3++3H2O?Fe(OH)3+3H+
Fe3++3H2O?Fe(OH)3+3H+
(4)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的C、E混合物 与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
①图2中oc段没有沉淀生成,此阶段发生反应的离子方程式为
H++OH-=H2O
H++OH-=H2O
.②在de段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式
NH4++OH-=NH3?H2O
NH4++OH-=NH3?H2O
;上述现象说明溶液中
H+
H+
结合OHˉ的能力最强(填离子符号).③b与a的差值为
0.008mol
0.008mol
mol.
分析:A是一种高熔点物质,可在高温下电解,应为氧化铝,则B为O2,D是一种红棕色固体,应为Fe2O3,与Al发生铝热反应,则E为Fe,根据反应关系可知H为NaAlO2,I为AlCl3,F为FeCl2,G为Fe(OH)2,J为Fe(OH)3,然后结合元素化合物性质及化学用语来解答.
解答:解:A是一种高熔点物质,可在高温下电解,应为氧化铝,则B为O2,D是一种红棕色固体,应为Fe2O3,与Al发生铝热反应,则E为Fe,根据反应关系可知H为NaAlO2,I为AlCl3,F为FeCl2,G为Fe(OH)2,J为Fe(OH)3,
(1)A为Al2O3,故答案为:Al2O3;
(2)H溶液中通入过量的CO2的离子方程式是[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-,G→J的化学方程式为为4Fe(OH)2+2H2O+O2═4Fe(OH)3,
故答案为:[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-;
(3)D物质恰好溶于一定量的稀盐酸后生成氯化铁溶液,因水解溶液显酸性,则Fe3++3H2O?Fe(OH)3+3H+,故答案为:Fe3++3H2O?Fe(OH)3+3H+;
(4)随着NaOH的滴加,发生的反应依次有H++OH-=H2O、Fe3++3OH-=Fe(OH)3↓、Al3++3OH-=Al(OH)3↓、NH4++OH-═NH3?H2O、Al(OH)3 +OH-=AlO2-+2H2O,
①oc段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-=H2O,故答案为:H++OH-=H2O;
②de段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为NH4++OH-=NH3?H2O,由反应的先后顺序可知,H+结合OHˉ能力强,
故答案为:NH4++OH-=NH3?H2O;H+;
③由图可知,ef段消耗的氢氧化钠溶液为36mL-34m=2mL,故该计算参加反应的氢氧化钠为0.002L×4mol/L=0.008mol,b与a的差值为氢氧化铝的质量,根据Al(OH)3 +OH-=AlO2-+2H2O可知,Al(OH)3的物质的量为0.008mol,故答案为:0.008mol.
(1)A为Al2O3,故答案为:Al2O3;
(2)H溶液中通入过量的CO2的离子方程式是[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-,G→J的化学方程式为为4Fe(OH)2+2H2O+O2═4Fe(OH)3,
故答案为:[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-;
(3)D物质恰好溶于一定量的稀盐酸后生成氯化铁溶液,因水解溶液显酸性,则Fe3++3H2O?Fe(OH)3+3H+,故答案为:Fe3++3H2O?Fe(OH)3+3H+;
(4)随着NaOH的滴加,发生的反应依次有H++OH-=H2O、Fe3++3OH-=Fe(OH)3↓、Al3++3OH-=Al(OH)3↓、NH4++OH-═NH3?H2O、Al(OH)3 +OH-=AlO2-+2H2O,
①oc段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-=H2O,故答案为:H++OH-=H2O;
②de段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为NH4++OH-=NH3?H2O,由反应的先后顺序可知,H+结合OHˉ能力强,
故答案为:NH4++OH-=NH3?H2O;H+;
③由图可知,ef段消耗的氢氧化钠溶液为36mL-34m=2mL,故该计算参加反应的氢氧化钠为0.002L×4mol/L=0.008mol,b与a的差值为氢氧化铝的质量,根据Al(OH)3 +OH-=AlO2-+2H2O可知,Al(OH)3的物质的量为0.008mol,故答案为:0.008mol.
点评:本题考查无机物的推断,题目难度中等,本题注意根据物质反应的条件以及物质的颜色,为推断该题的突破口,明确物质的种类为解答该题的关键,易错点为(4),注意题给信息.

练习册系列答案
相关题目





