题目内容
将51.2g铜恰好完全溶于一定量的硝酸溶液中,得到硝酸铜溶液,收集到氮的氧化物(含NO、NO2、N2O4)的混合物共17.92L(标准状况),在这些气体中通入VL(标准状况)的氧气后用一定量的氢氧化钠溶液吸收,结果剩余2.24L(标准状况)气体。则通入氧气的体积V为
A.7.28L B.8.96L C.11.20L D.16.8L
AC
【解析】
试题分析:当硝酸为浓硝酸时,硝酸被还原成二氧化氮Cu + 4HNO3 = Cu(NO3)2
+ 2NO2↑ + 2H2O当硝酸为稀硝酸是,硝酸被还原成一氧化氮3Cu + 8HNO3 =3 Cu(NO3)2 + 2NO↑ + 4H2O可以合并方程式2Cu + 6HNO3 =2 Cu(NO3)2
+ NO↑+ NO2↑ + 3H2O,51.2g铜=0.8mol,故产生NO=0.4mol,NO2=0.4mol.又因为 2NO2 N2O4。当通入VL(标准状况)的氧气后用一定量的氢氧化钠溶液吸收,结果剩余2.24L(标准状况)气体时有两种可能,①氧气过量:则通入氧气的量为:
N2O4。当通入VL(标准状况)的氧气后用一定量的氢氧化钠溶液吸收,结果剩余2.24L(标准状况)气体时有两种可能,①氧气过量:则通入氧气的量为:
NO---O2 NO2---O2
4 3 4 1
0.4 (0.3) 0.4 (0.1)
n(O2)=0.3mol+0.1mol=0.4mol,则总体积为0.4mol×22.4L/mol+2.24L=11.2L。
②当氧气量不足时,则NO剩余2.24L,为0.1mol。
NO---O2 NO2---O2
4 3 4 1
0. 3 (0.225) 0.4 (0.1)
n(O2)=0.225mol+0.1mol=0.325mol,体积为0.325mol×22.4mol/L=7.28L
考点:氧化还原反应计算。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案 2NO2
2NO2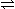 2NO2
2NO2