网址:http://m.1010jiajiao.com/timu3_id_58532[举报]
X、Y、Z、Q、E、F六种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在第二周期主族元素中电负性最大的元素.
请回答下列问题:
(1)XZ2与YZ2分子的立体结构分别是
(2)Q的元素符号是
(3)用氢键表示式写出E的氢化物溶液中存在的所有氢键
(4)F的氢化物是一种碱性气体,F还可与氢形成离子化合物FH5,
 其电子式为
其电子式为

| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义。
(1)在光照条件下,氯气和氢气反应过程如下:
①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl
反应②中被破坏的化学键是——,氯元素的原子结构示意图为——。。
(2)二氧化氯(ClO2)是一种广泛用于水处理消毒剂,与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有害的有机氯化物。制备ClO2的方法有以下两种:
2NaClO3+4HCl===2ClO2↑+Cl2+2NaCl+2H2O…………………………①
2NaClO2+H2O2+H2SO4===2C1O2↑+O2↑+Na2SO4+2H2O …………………②
你认为哪种方法最佳 (填序号),理由是 。
(3)工业上用电解饱和食盐水的方法制取烧碱和氯气,请写出反应的离子方程式
。
(4)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)![]()
![]() WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t??2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t??2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
或“等于”或“小于”)

②从反应开始到t1时间内的平均反应速率
v(I2)= 。
③下列说法中不正确的是 (填序号)。
A.该反应的平衡常数表达式是![]()
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(5)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是 ,溶液中离子浓度由大到小的顺序是 [不考虑H+和OH-。25℃时KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
(6)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl(g)==MgCl2(s)△H=—641kJ/mol
②Ti(s)+2Cl2(g)===TiCl2(l) △H=—770kJ/mol
请写出Mg与液态TiCl4反应提纯钛的热化学方程式 。
查看习题详情和答案>>(14分)
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义。
(1)在光照条件下,氯气和氢气反应过程如下:
①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl
反应②中被破坏的化学键是——,氯元素的原子结构示意图为——。。
(2)二氧化氯(ClO2)是一种广泛用于水处理消毒剂,与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有害的有机氯化物。制备ClO2的方法有以下两种:
2NaClO3+4HCl===2ClO2↑+Cl2+2NaCl+2H2O…………………………①
2NaClO2+H2O2+H2SO4===2C1O2↑+O2↑+Na2SO4+2H2O …………………②
你认为哪种方法最佳 (填序号),理由是 。
(3)工业上用电解饱和食盐水的方法制取烧碱和氯气,请写出反应的离子方程式
。
(4)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)![]()
![]() WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
或“等于”或“小于”)
②从反应开始到t1时间内的平均反应速率
v(I2)= 。
③下列说法中不正确的是 (填序号)。
A.该反应的平衡常数表达式是![]()
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(5)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是 ,溶液中离子浓度由大到小的顺序是 [不考虑H+和OH-。25℃时KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
(6)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl(g)==MgCl2(s)△H=—641kJ/mol
②Ti(s)+2Cl2(g)===TiCl2(l) △H=—770kJ/mol
请写出Mg与液态TiCl4反应提纯钛的热化学方程式 。
查看习题详情和答案>>
(14分)
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义。
(1)在光照条件下,氯气和氢气反应过程如下:
①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl
反应②中被破坏的化学键是——,氯元素的原子结构示意图为——。。
(2)二氧化氯(ClO2)是一种广泛用于水处理消毒剂,与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有害的有机氯化物。制备ClO2的方法有以下两种:
2NaClO3+4HCl===2ClO2↑+Cl2+2NaCl+2H2O…………………………①
2NaClO2+H2O2+H2SO4===2C1O2↑+O2↑+Na2SO4+2H2O …………………②
你认为哪种方法最佳 (填序号),理由是 。
(3)工业上用电解饱和食盐水的方法制取烧碱和氯气,请写出反应的离子方程式
。
(4)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)
 WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
或“等于”或“小于”)

②从反应开始到t1时间内的平均反应速率
v(I2)= 。
③下列说法中不正确的是 (填序号)。
A.该反应的平衡常数表达式是
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(5)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是 ,溶液中离子浓度由大到小的顺序是 [不考虑H+和OH-。25℃时KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
(6)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl(g)==MgCl2(s)△H=—641kJ/mol
②Ti(s)+2Cl2(g)===TiCl2(l) △H=—770kJ/mol
请写出Mg与液态TiCl4反应提纯钛的热化学方程式 。
查看习题详情和答案>>
【化学——选修3:物质结构与性质】(15分)
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为____________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________。
| | 氟 | 氯 | 溴 | 碘 |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 |
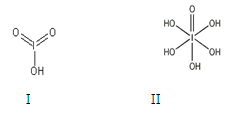
请比较二者酸性强弱:HIO3_____ H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2- 为角型,中心氯原子周围有四对价层电子。ClO2- 中心氯原子的杂化轨道类型为___________,写出一个ClO2- 的等电子体__________。
(6)下图为碘晶体晶胞结构。有关说法中正确的是_____________。
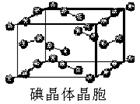
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
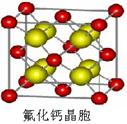
(7)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
 查看习题详情和答案>>
查看习题详情和答案>>