��Ŀ����
��14�֣�
±�ص��ʵ����ʻ��ã�±�صĻ�����Ӧ�ù㷺���о�±�ص��ʼ��仯���������Ҫ���塣
��1���ڹ��������£�������������Ӧ�������£�
��Cl2��Cl+Cl ��Cl+H2��HCl+H ��H+Cl2��HCl+Cl
��Ӧ���б��ƻ��Ļ�ѧ���ǡ�������Ԫ�ص�ԭ�ӽṹʾ��ͼΪ��������
��2���������ȣ�ClO2����һ�ֹ㷺����ˮ��������������Cl2��ȣ�ClO2�������и�������ɱ�����������Ҳ�������������к����л��Ȼ���Ʊ�ClO2�ķ������������֣�
2NaClO3+4HCl===2ClO2��+Cl2+2NaCl+2H2O����������������������
2NaClO2+H2O2+H2SO4===2C1O2��+O2��+Na2SO4+2H2O ����������������
����Ϊ���ַ������ ������ţ��������� ��
��3����ҵ���õ�ⱥ��ʳ��ˮ�ķ�����ȡ�ռ����������д����Ӧ�����ӷ���ʽ
��
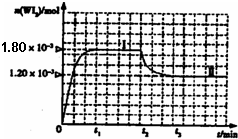
��4�����ٵƾ��бȰ׳���������һ������ܵ��ص㡣һ���¶��£������ڷ�����������ʹ�ù����г����ڹܱ��ϵ��ٿ��Է�����Ӧ��W(s)+I2(g)![]()
![]() WI2(g)��Ϊģ��������Ӧ��ȷ��ȡ0.508g�⡢0.736g����������50.0mL���ܱ������У�����ʹ�䷴Ӧ����ͼ��WI2��g�������ʵ�����ʱ��仯��ϵͼ����������I��0~t2ʱ��Σ��ķ�Ӧ�¶�ΪT1������II����t2��ʼ���ķ�Ӧ�¶�ΪT2����T2>T1���ٸ÷�Ӧ�ġ�H 0������ڡ�
WI2(g)��Ϊģ��������Ӧ��ȷ��ȡ0.508g�⡢0.736g����������50.0mL���ܱ������У�����ʹ�䷴Ӧ����ͼ��WI2��g�������ʵ�����ʱ��仯��ϵͼ����������I��0~t2ʱ��Σ��ķ�Ӧ�¶�ΪT1������II����t2��ʼ���ķ�Ӧ�¶�ΪT2����T2>T1���ٸ÷�Ӧ�ġ�H 0������ڡ�
���ڡ���С�ڡ���
�ڴӷ�Ӧ��ʼ��t1ʱ���ڵ�ƽ����Ӧ����
v(I2)= ��
������˵���в���ȷ���� ������ţ���
A���÷�Ӧ��ƽ�ⳣ������ʽ��![]()
B����˿�����¶�Խ�ߣ���˿��������WI2Խ�ױ�ΪW�����³�������˿��
C�����ø÷�Ӧԭ�������ᴿ��
��5��25��ʱ����5mL����KCl��KIŨ�Ⱦ�Ϊ0.1mol/L�Ļ��Һ�У��μ�6mL0.1mol/L��AgNO3��Һ�������ɵij����� ����Һ������Ũ���ɴ�С��˳���� [������H+��OH-��25��ʱKSP��AgCl��=1.8��10-10��KSP��AgI��=8.3��10-17]��
��6��Mg�������ᴿTi���Լ�����֪��
��Mg��s��+Cl��g��==MgCl2��s����H=��641kJ/mol
��Ti(s)+2Cl2(g)===TiCl2(l) ��H=��770kJ/mol
��д��Mg��Һ̬TiCl4��Ӧ�ᴿ�ѵ��Ȼ�ѧ����ʽ ��
��1�� H��H����1�֣� ��1�֣�
��2���ڣ�1�֣� ClO2�л���O2���������������Ժ������ʣ�1�֣�
��3��2C1-+2H2O![]() Cl2��+H2��+2OH-��2�֣�
Cl2��+H2��+2OH-��2�֣�
��4����С�ڣ�1�֣� ��![]() mol��L-1��min-1��1�֣���A��1�֣�
mol��L-1��min-1��1�֣���A��1�֣�
��5��AgI��1�֣� c��K+��>c��NO-3��>c��Cl-��>c��Ag+��>c��I-����2�֣�
��6��2Mg��s��+TiCl4��1��==2MgCl2��s��+Ti��s�� ��H=һ512kJ��mol-1��2�֣�
����:

 ��2010?��ׯһģ��±�ص��ʵ����ʻ��ã�±�صĻ�����Ӧ�ù㷺���о�±�ص��ʼ��仯���������Ҫ���壮
��2010?��ׯһģ��±�ص��ʵ����ʻ��ã�±�صĻ�����Ӧ�ù㷺���о�±�ص��ʼ��仯���������Ҫ���壮








 WI2(g)��Ϊģ��������Ӧ��ȷ��ȡ0.508g�⡢0.736g����������50.0mL���ܱ������У�����ʹ�䷴Ӧ����ͼ��WI2��g�������ʵ�����ʱ��仯��ϵͼ����������I��0~t2ʱ��Σ��ķ�Ӧ�¶�ΪT1������II����t2��ʼ���ķ�Ӧ�¶�ΪT2����T2>T1���ٸ÷�Ӧ�ġ�H 0������ڡ�
WI2(g)��Ϊģ��������Ӧ��ȷ��ȡ0.508g�⡢0.736g����������50.0mL���ܱ������У�����ʹ�䷴Ӧ����ͼ��WI2��g�������ʵ�����ʱ��仯��ϵͼ����������I��0~t2ʱ��Σ��ķ�Ӧ�¶�ΪT1������II����t2��ʼ���ķ�Ӧ�¶�ΪT2����T2>T1���ٸ÷�Ӧ�ġ�H 0������ڡ�
