网址:http://m.1010jiajiao.com/timu3_id_58530[举报]
(10分)碳酸钠与工农业生产、日常生活紧密相关.工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:沉淀分析法
(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀_________(填操作步骤)、洗涤、烘干、称量。洗涤沉淀的操作是________________________________。
方案二:气体分析法
(2)把一定量的样品与足量盐酸反应后,用如图装置测
定产生CO2气体的体积,为了测定结果准确,B中
的溶液最好采用____________,从下列各选项中选
取:
a.饱和碳酸钠溶液 b.饱和碳酸碳酸氢钠溶液.
c.饱和氢氧化钠溶液 d.饱和硫酸铜溶液。
若直接采用如图装置, 选用该溶液后实验结果仍
然不够准确,其原因可能是________________________________________。
方案三:质量差分析法
(3)把一定质量的样品和足量的稀硫酸反应,采用如图所示装置,通过称量反应前后盛有碱石灰的干燥管质量,利用其质量差求算样品的纯度.该实验的操作步骤有:①在干燥管内填满碱石灰,质量为m g ②取n g样品装入广口瓶中 ③检验装置的气密性。④缓慢鼓入空气数分钟,再称量干燥管质量为w g ⑤关闭止水夹 ⑥打并止水夹 ⑦缓慢加入稀硫酸至不再产生气体为止 ⑧缓慢鼓入空气数分钟。
I.正确的操作顺序是(填写序号):
③→_______→⑥→________→⑤→_______→⑦→__________→④
Ⅱ.若去掉装置A,测定结果___________;若去掉装置B,测定结果__________(填“偏大”、“偏小”或“无影响”).
查看习题详情和答案>>
(10分)碳酸钠与工农业生产、日常生活紧密相关.工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:沉淀分析法
(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀_________(填操作步骤)、洗涤、烘干、称量。洗涤沉淀的操作是________________________________。
方案二:气体分析法
(2)把一定量的样品与足量盐酸反应后,用如图装置测
定产生CO2气体的体积,为了测定结果准确,B中
的溶液最好采用____________,从下列各选项中选
取:
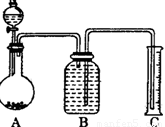
a.饱和碳酸钠溶液 b.饱和碳酸碳酸氢钠溶液.
c.饱和氢氧化钠溶液 d.饱和硫酸铜溶液。
若直接采用如图装置, 选用该溶液后实验结果仍
然不够准确,其原因可能是________________________________________。
方案三:质量差分析法
(3)把一定质量的样品和足量的稀硫酸反应,采用如图所示装置,通过称量反应前后盛有碱石灰的干燥管质量,利用其质量差求算样品的纯度.该实验的操作步骤有:①在干燥管内填满碱石灰,质量为m g ②取n g样品装入广口瓶中 ③检验装置的气密性。④缓慢鼓入空气数分钟,再称量干燥管质量为w g ⑤关闭止水夹 ⑥打并止水夹 ⑦缓慢加入稀硫酸至不再产生气体为止 ⑧缓慢鼓入空气数分钟。
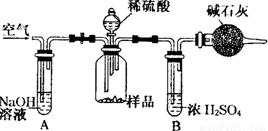
I.正确的操作顺序是(填写序号):
③→_______→⑥→________→⑤→_______→⑦→__________→④
Ⅱ.若去掉装置A,测定结果___________;若去掉装置B,测定结果__________(填“偏大”、“偏小”或“无影响”).
查看习题详情和答案>>
利用化学原理可以对工厂排放的废水进行有效检测与合理处理.
(1)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体).除去NO2-的离子方程式为
________.(2)废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去.
①方法一:将Ca(OH)2或CaO投加到待处理的废水中,生成磷酸钙,从而进行回收.当处理后的废水中c(Ca2+)=2×10-7 mol/L时,溶液中c(PO43-)=
________mol/L.(已知Ksp[Ca3(PO4)2]=2×10-33)②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石―鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓.该方法中需要控制污水的pH为7.5~10,若pH高于10.7,鸟粪石的产量会大大降低.其原因可能为
_____________.与方法一相比,方法二的优点为_______________.(3)三氯乙烯在印刷、纺织等行业应用广泛,为了减少其对环境的影响,可将三氯乙烯在二氧化钛薄膜上催化降解,其反应的机理如下:
●CCl2=CHCl+Cl→CCl2CHCl2
●CCl2CHCl2+O2→OOCCl2CHCl2
●
OOCCl2CHCl2→OCCl2CHCl2+1/2O2●OCCl2CHCl2→CHCl2COCl+Cl
该反应的总化学反应为
_____________.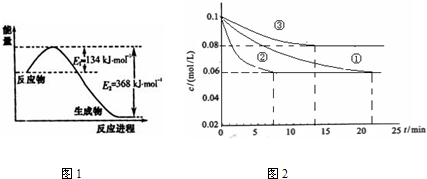
(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程的总反应式为:N2+3H2
| ||
| (一定条件) |
阳极反应式为:3H2-6e-=6H+,则阴极反应式为
(3)工业中常用以下反应合成氨:N2+3H2?2NH3△H<0.某实验室在三个不同条件的密闭容器中,分别加入浓度均为c (N2)=0.1mol/L,c (H2)=0.3mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示.
I.该反应实验②平衡时H2的转化率为
II.据图2所示,②、③两装置中各有一个条件与①不同.请指出,并说明判断的理由.③条件:
该反应为放热反应,温度升高,达到平衡的时间缩短,但平衡向逆反应方向移动,③中到达平衡时N2的浓度高于①
该反应为放热反应,温度升高,达到平衡的时间缩短,但平衡向逆反应方向移动,③中到达平衡时N2的浓度高于①
(4)I.NH4Cl溶液呈酸性,这是由于NH4+水解的缘故.则NH4Cl溶于重水(D2O)生成一水合氨和水合氢离子的离子方程式是
II.常温下,0.1mol?L-1氨水与0.1mol?L-1盐酸溶液等体积混合(忽略混合后溶液体积的变化),则混合溶液中由水电离出的c(H+)
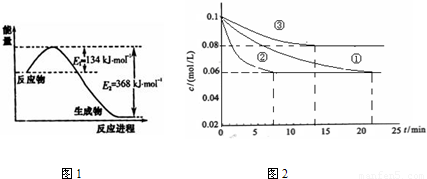
(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程的总反应式为:N2+3H2
 2NH3,
2NH3,阳极反应式为:3H2-6e-=6H+,则阴极反应式为 .
(3)工业中常用以下反应合成氨:N2+3H2?2NH3△H<0.某实验室在三个不同条件的密闭容器中,分别加入浓度均为c (N2)=0.1mol/L,c (H2)=0.3mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示.
I.该反应实验②平衡时H2的转化率为 .
II.据图2所示,②、③两装置中各有一个条件与①不同.请指出,并说明判断的理由.③条件: 理由: .
(4)I.NH4Cl溶液呈酸性,这是由于NH4+水解的缘故.则NH4Cl溶于重水(D2O)生成一水合氨和水合氢离子的离子方程式是 .
II.常温下,0.1mol?L-1氨水与0.1mol?L-1盐酸溶液等体积混合(忽略混合后溶液体积的变化),则混合溶液中由水电离出的c(H+) 0.1mol?L-1氨水溶液中由水电离出的c(OH-)(填写“>”“=”或“<”)
 查看习题详情和答案>>
查看习题详情和答案>>