��Ŀ����
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã���ش��������⣺
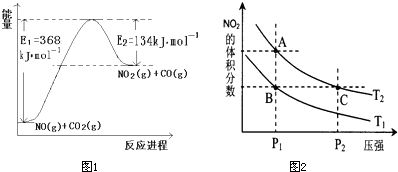
��1��ͼ1��1mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ
��2����ҵ�ϳɰ�����Ҫ�ķ�Ӧ�����dz����Ҳ����ͣ���һЩ��ѧ�Ҳ��ø����ӵ����Ե�SCY�մɣ��ܴ���H+��ʵ�ְ��ĵ绯ѧ�ϳɣ��Ӷ��������˵�����������ת���ʣ��绯ѧ�ϳɰ����̵��ܷ�ӦʽΪ��N2+3H2
 2NH3��
2NH3��������ӦʽΪ��3H2-6e-=6H+����������ӦʽΪ ��
��3����ҵ�г������·�Ӧ�ϳɰ���N2+3H2?2NH3��H��0��ijʵ������������ͬ�������ܱ������У��ֱ����Ũ�Ⱦ�Ϊc ��N2��=0.1mol/L��c ��H2��=0.3mol/L���з�Ӧʱ��N2��Ũ����ʱ��ı仯����ͼ�١��ڡ���������ʾ��
I���÷�Ӧʵ���ƽ��ʱH2��ת����Ϊ ��
II����ͼ2��ʾ���ڡ�����װ���и���һ��������ٲ�ͬ����ָ������˵���жϵ����ɣ��������� ���ɣ� ��
��4��I��NH4Cl��Һ�����ԣ���������NH4+ˮ���Ե�ʣ���NH4Cl������ˮ��D2O������һˮ�ϰ���ˮ�������ӵ����ӷ���ʽ�� ��
II�������£�0.1mol?L-1��ˮ��0.1mol?L-1������Һ�������ϣ����Ի�Ϻ���Һ����ı仯����������Һ����ˮ�������c��H+�� 0.1mol?L-1��ˮ��Һ����ˮ�������c��OH-������д��������=��������
���𰸡���������1�������Ȼ�ѧ����ʽ����д�����ͺ������ش�
��2�������缫��Ӧ=�ܷ�Ӧ-�����缫��Ӧ��
��3��ʵ���ƽ��ʱH2��ת����Ϊ����H2��= ×100%���ڵ���ƽ���ʱ��Ȣٶ̣�����ƽ��ʱN2��Ũ�������ͬ����ѧƽ�ⲻ�ƶ����۵���ƽ���ʱ��Ȣٶ̣�����ƽ��ʱN2��Ũ�ȸ��ڢ٣������ȣ�ƽ�����淴Ӧ�����ƶ���
×100%���ڵ���ƽ���ʱ��Ȣٶ̣�����ƽ��ʱN2��Ũ�������ͬ����ѧƽ�ⲻ�ƶ����۵���ƽ���ʱ��Ȣٶ̣�����ƽ��ʱN2��Ũ�ȸ��ڢ٣������ȣ�ƽ�����淴Ӧ�����ƶ���
��4������ˮ���ʵ������д���ӷ�Ӧ��
����ˮ����ζ�ˮ�ĵ�����ٽ����ã������ˮ�ĵ������������ã�
����⣺��1������ͼʾ1mol NO2��1mol CO��Ӧ����CO2��NO�����������仯Ϊ�ų�234KJ�����������Ȼ�ѧ����ʽΪ��NO2��g��+CO��g���TCO2��g��+NO��g������H=-234KJ/mol��
�ʴ�Ϊ��NO2��g��+CO��g���TCO2��g��+NO��g������H=-234KJ/mol��
��2���ܷ�ӦʽΪ��N2+3H2 2NH3��������ӦʽΪ��3H2-6e-=6H+����������Ӧʽ=�ܷ�Ӧ-������Ӧ=N2+6H+=6e-+2NH3���ʴ�Ϊ��N2+6H+=6e-+2NH3��
2NH3��������ӦʽΪ��3H2-6e-=6H+����������Ӧʽ=�ܷ�Ӧ-������Ӧ=N2+6H+=6e-+2NH3���ʴ�Ϊ��N2+6H+=6e-+2NH3��
��3������ΪŨ�ȱ仯��֮�ȵ��ڻ�ѧ������֮�ȣ����ԡ�c��H2��=3��c��N2��=3×��0.1-0.06 ��mol/L=0.12mol/L��
ʵ���ƽ��ʱH2��ת����Ϊ����H2��= ×100%=
×100%=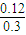 ×100%=40%���ʴ�Ϊ��40%��
×100%=40%���ʴ�Ϊ��40%��
����ͼʾ����Ϣ��֪���ڵ���ƽ���ʱ��Ȣٶ̣�����ƽ��ʱN2��Ũ�������ͬ����ѧƽ�ⲻ�ƶ����ʢ������ȼ��˴������۵���ƽ���ʱ��Ȣٶ̣�����ƽ��ʱN2��Ũ�ȸ��ڢ٣������ȣ�ƽ�����淴Ӧ�����ƶ����ʢ��������¶����ߣ�
�ʴ�Ϊ���������ȼ��˴��������������¶����ߣ���Ϊ������������̴ﵽƽ���ʱ�䣬����ѧƽ�ⲻ�ƶ������Ԣ٢���װ�ôﵽƽ��ʱN2��Ũ����ͬ���÷�ӦΪ���ȷ�Ӧ���¶����ߣ��ﵽƽ���ʱ�����̣���ƽ�����淴Ӧ�����ƶ������е���ƽ��ʱN2��Ũ�ȸ��ڢ٣�
��4��I������D2O=D++OD-����NH4++OD-=NH3?HDO��NH4Cl������ˮ��D2O������һˮ�ϰ���ˮ�������ӵ����ӷ���ʽ�ǣ�NH4++D2O=NH3?HDO+D3O+���ʴ�Ϊ��NH4++D2O=NH3?HDO+D3O+��
��0.1mol?L-1��ˮ��0.1mol?L-1������Һ�������ϣ����Ի�Ϻ���Һ����ı仯�����õ�Ũ��Ϊ0.05mol/L���Ȼ����Һ����ܣ��Ȼ�臨�ˮ�ĵ����ٽ����ã�0.1mol?L-1��ˮ��Һ��ˮ�ĵ��������ƣ����Ի����Һ����ˮ�������c��H+������0.1mol?L-1��ˮ��Һ����ˮ�������c��OH-�����ʴ�Ϊ������
������������һ���Ȼ�ѧ���绯ѧ����ѧƽ����ε�ˮ��֪ʶ���ϵ��ۺ���Ŀ������Ƕȹ㣬�ѶȺܴ�
��2�������缫��Ӧ=�ܷ�Ӧ-�����缫��Ӧ��
��3��ʵ���ƽ��ʱH2��ת����Ϊ����H2��=
 ×100%���ڵ���ƽ���ʱ��Ȣٶ̣�����ƽ��ʱN2��Ũ�������ͬ����ѧƽ�ⲻ�ƶ����۵���ƽ���ʱ��Ȣٶ̣�����ƽ��ʱN2��Ũ�ȸ��ڢ٣������ȣ�ƽ�����淴Ӧ�����ƶ���
×100%���ڵ���ƽ���ʱ��Ȣٶ̣�����ƽ��ʱN2��Ũ�������ͬ����ѧƽ�ⲻ�ƶ����۵���ƽ���ʱ��Ȣٶ̣�����ƽ��ʱN2��Ũ�ȸ��ڢ٣������ȣ�ƽ�����淴Ӧ�����ƶ�����4������ˮ���ʵ������д���ӷ�Ӧ��
����ˮ����ζ�ˮ�ĵ�����ٽ����ã������ˮ�ĵ������������ã�
����⣺��1������ͼʾ1mol NO2��1mol CO��Ӧ����CO2��NO�����������仯Ϊ�ų�234KJ�����������Ȼ�ѧ����ʽΪ��NO2��g��+CO��g���TCO2��g��+NO��g������H=-234KJ/mol��
�ʴ�Ϊ��NO2��g��+CO��g���TCO2��g��+NO��g������H=-234KJ/mol��
��2���ܷ�ӦʽΪ��N2+3H2
 2NH3��������ӦʽΪ��3H2-6e-=6H+����������Ӧʽ=�ܷ�Ӧ-������Ӧ=N2+6H+=6e-+2NH3���ʴ�Ϊ��N2+6H+=6e-+2NH3��
2NH3��������ӦʽΪ��3H2-6e-=6H+����������Ӧʽ=�ܷ�Ӧ-������Ӧ=N2+6H+=6e-+2NH3���ʴ�Ϊ��N2+6H+=6e-+2NH3����3������ΪŨ�ȱ仯��֮�ȵ��ڻ�ѧ������֮�ȣ����ԡ�c��H2��=3��c��N2��=3×��0.1-0.06 ��mol/L=0.12mol/L��
ʵ���ƽ��ʱH2��ת����Ϊ����H2��=
 ×100%=
×100%=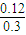 ×100%=40%���ʴ�Ϊ��40%��
×100%=40%���ʴ�Ϊ��40%������ͼʾ����Ϣ��֪���ڵ���ƽ���ʱ��Ȣٶ̣�����ƽ��ʱN2��Ũ�������ͬ����ѧƽ�ⲻ�ƶ����ʢ������ȼ��˴������۵���ƽ���ʱ��Ȣٶ̣�����ƽ��ʱN2��Ũ�ȸ��ڢ٣������ȣ�ƽ�����淴Ӧ�����ƶ����ʢ��������¶����ߣ�
�ʴ�Ϊ���������ȼ��˴��������������¶����ߣ���Ϊ������������̴ﵽƽ���ʱ�䣬����ѧƽ�ⲻ�ƶ������Ԣ٢���װ�ôﵽƽ��ʱN2��Ũ����ͬ���÷�ӦΪ���ȷ�Ӧ���¶����ߣ��ﵽƽ���ʱ�����̣���ƽ�����淴Ӧ�����ƶ������е���ƽ��ʱN2��Ũ�ȸ��ڢ٣�
��4��I������D2O=D++OD-����NH4++OD-=NH3?HDO��NH4Cl������ˮ��D2O������һˮ�ϰ���ˮ�������ӵ����ӷ���ʽ�ǣ�NH4++D2O=NH3?HDO+D3O+���ʴ�Ϊ��NH4++D2O=NH3?HDO+D3O+��
��0.1mol?L-1��ˮ��0.1mol?L-1������Һ�������ϣ����Ի�Ϻ���Һ����ı仯�����õ�Ũ��Ϊ0.05mol/L���Ȼ����Һ����ܣ��Ȼ�臨�ˮ�ĵ����ٽ����ã�0.1mol?L-1��ˮ��Һ��ˮ�ĵ��������ƣ����Ի����Һ����ˮ�������c��H+������0.1mol?L-1��ˮ��Һ����ˮ�������c��OH-�����ʴ�Ϊ������
������������һ���Ȼ�ѧ���绯ѧ����ѧƽ����ε�ˮ��֪ʶ���ϵ��ۺ���Ŀ������Ƕȹ㣬�ѶȺܴ�

��ϰ��ϵ�д�
 ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д�
�����Ŀ
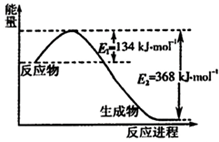 ���ǵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���壮
���ǵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���壮