题目内容
(10分)碳酸钠与工农业生产、日常生活紧密相关.工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:沉淀分析法
(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀_________(填操作步骤)、洗涤、烘干、称量。洗涤沉淀的操作是________________________________。
方案二:气体分析法
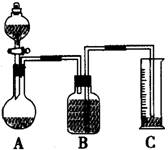
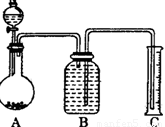
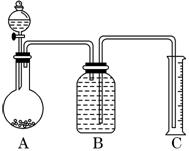
(2)把一定量的样品与足量盐酸反应后,用如图装置测
定产生CO2气体的体积,为了测定结果准确,B中
的溶液最好采用____________,从下列各选项中选
取:
a.饱和碳酸钠溶液 b.饱和碳酸碳酸氢钠溶液.
c.饱和氢氧化钠溶液 d.饱和硫酸铜溶液。
若直接采用如图装置, 选用该溶液后实验结果仍
然不够准确,其原因可能是________________________________________。
方案三:质量差分析法
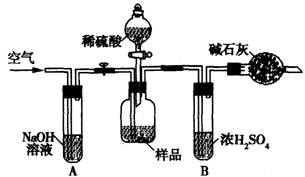
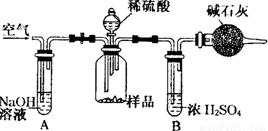
(3)把一定质量的样品和足量的稀硫酸反应,采用如图所示装置,通过称量反应前后盛有碱石灰的干燥管质量,利用其质量差求算样品的纯度.该实验的操作步骤有:①在干燥管内填满碱石灰,质量为m g ②取n g样品装入广口瓶中 ③检验装置的气密性。④缓慢鼓入空气数分钟,再称量干燥管质量为w g ⑤关闭止水夹 ⑥打并止水夹 ⑦缓慢加入稀硫酸至不再产生气体为止 ⑧缓慢鼓入空气数分钟。
I.正确的操作顺序是(填写序号):
③→_______→⑥→________→⑤→_______→⑦→__________→④
Ⅱ.若去掉装置A,测定结果___________;若去掉装置B,测定结果__________(填“偏大”、“偏小”或“无影响”).
(1)过滤(1分),向过滤器中的沉淀加蒸馏水至浸没过沉淀物,使水自然流下,重复2~3次(2分)
(2)b(1分), CO2气体中混有的HCl气体与NaHCO3溶液作用生成CO2(2分)
(3)Ⅰ.② ⑧ ① ⑥(2分) Ⅱ.偏大 偏大(各1分,共2分)
解析:本题考查实验探究知识及碳酸钠的性质及应用。 测定碳酸钠样品(样品中混有氯化钠)中碳酸钠的质量分数,即想法得到一定质量的样品中合有Na2CO3的质量,方法有:设法将Na2CO3或NaCl转化为沉淀或将Na2CO3转化为气体,然后测定沉淀的质量或气体的体积或气体的质量来求算。(1)中沉淀应过滤出来,然后洗涤、干燥、称量。(2)中为保证CO2 气体不溶于B瓶液体,瓶中液体应盛饱和NaHCO3溶液以降低CO2 的溶解度;但A中所用盐酸具有挥发性,因此CO2气体中会混有HCl,HCl会与NaHCO3溶液作用生成CO2,从而导致CO2的体积要比实际的多。(3)依据实验目的,结合各装置中试剂的性质,不难确定各装置的作用和操作顺序等。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案