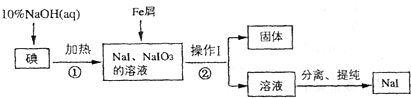
摘要:13.电子天平是定量分析中常用精密仪器.下列关于电子天平的说法正确的是 ( ) A.电子天平操作方便.读数稳定.准确度高.不同型号的电子天平具有相同的精确度 B.电子天平是电子仪器.十分精密.不需要校准和调零 C.电子天平具有归零键.因此烧杯不洁净或者潮湿都不影响使用 D.天平使用时.要关上附件的窗户.不要撞击天平使用所在的桌面,读数时.侧门应关闭.防止气流影响称重
网址:http://m.1010jiajiao.com/timu3_id_57505[举报]
已知A为常见金属,常温下X、E、F为气体,C为液体.B是一种盐,受热易分解,冷却时分解产物又能化合生成B,B在工农业生产中有着广泛的用途.有关物质之间的转化关系如图(其中有些反应的条件及部分生成物被略去):
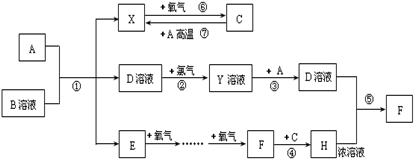
请回答下列问题:
(1)写出物质B的电子式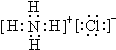
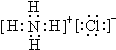 ;
;
(2)比较①~⑦七个反应,请归纳它们的共同特点是
(3)写出反应⑦的化学方程式
(4)写出过量A与H浓溶液反应的离子方程式
(5)D是实验中常用的物质,检验D是否变质的方法是:
查看习题详情和答案>>

请回答下列问题:
(1)写出物质B的电子式
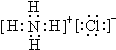
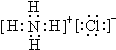
(2)比较①~⑦七个反应,请归纳它们的共同特点是
均为氧化还原反应
均为氧化还原反应
;(3)写出反应⑦的化学方程式
3Fe+4H2O
Fe3O4+4H2↑
| ||
3Fe+4H2O
Fe3O4+4H2↑
;
| ||
(4)写出过量A与H浓溶液反应的离子方程式
Fe+4H++2NO3-=Fe2++2NO2↑+2H2O
Fe+4H++2NO3-=Fe2++2NO2↑+2H2O
;(5)D是实验中常用的物质,检验D是否变质的方法是:
取少量样品于试管中,加入KSCN溶液,如果出现红色,说明变质;反之,没有变质
取少量样品于试管中,加入KSCN溶液,如果出现红色,说明变质;反之,没有变质
.2012年3月22日是第二十届“世界水日”,保护水资源,从我做起!
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂.当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的 倍.
(2)自来水厂常用高铁酸钠(Na2FeO4,强氧化剂)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理 .
(3)某无色废水中可能含有Fe2+、Al3+、Na+、NO3-、CO32-、SO42-离子中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关现象如图所示: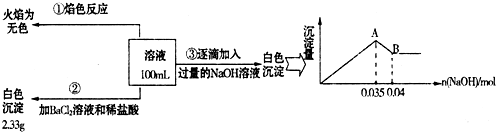
请根据上图回答下列问题:
①实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为 .
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为 .
③试确定NO3-是否存在? (填“存在”、“不存在”或“不确定”),若存在,试计算c(NO3-)= (若不存在,此问不必作答).
查看习题详情和答案>>
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂.当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的
(2)自来水厂常用高铁酸钠(Na2FeO4,强氧化剂)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理
(3)某无色废水中可能含有Fe2+、Al3+、Na+、NO3-、CO32-、SO42-离子中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关现象如图所示:

请根据上图回答下列问题:
①实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为
③试确定NO3-是否存在?
已知可充电电池是一种可反复使用的电池.铅蓄电池是生活中常用的可充电电池,其充电过程与放电过程是完全相反的两个过程.其反应总方程式为:Pb+PbO2+2H2SO4
2PbSO4+2H2O,请回答下列问题:放电时,给出电子的一极是
查看习题详情和答案>>
| 放电 | 充电 |
负极
负极
(填电极名称),发生氧化
氧化
反应(填反应类型),其电极反应式为:Pb-2e-+SO42-=PbSO4
Pb-2e-+SO42-=PbSO4
.该极充电时将发生还原
还原
反应(填反应类型).四种短周期主族元素A、B、C、D,它们原子的电子层数与最外层电子数之比分别为:3:1、1:1、1:2 和 1:3.下列说法正确的是( )
| A、根据上述信息可确定A与D只能形成一种化合物 | B、化合物ABCD3的水溶液一定呈碱性 | C、若B、D的单质可形成燃料电池,且以KOH为电解质溶液,则负极的电极反应式为:4OH--4e-═O2+2H2O | D、若B是生活中常用的金属,则B与D形成的化合物为离子晶体 |