题目内容
已知A为常见金属,常温下X、E、F为气体,C为液体.B是一种盐,受热易分解,冷却时分解产物又能化合生成B,B在工农业生产中有着广泛的用途.有关物质之间的转化关系如图(其中有些反应的条件及部分生成物被略去):
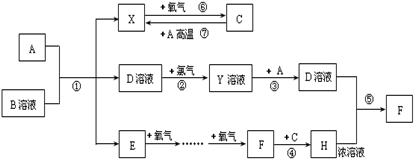
请回答下列问题:
(1)写出物质B的电子式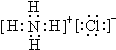
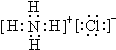 ;
;
(2)比较①~⑦七个反应,请归纳它们的共同特点是
(3)写出反应⑦的化学方程式
(4)写出过量A与H浓溶液反应的离子方程式
(5)D是实验中常用的物质,检验D是否变质的方法是:

请回答下列问题:
(1)写出物质B的电子式
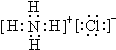
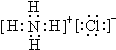
(2)比较①~⑦七个反应,请归纳它们的共同特点是
均为氧化还原反应
均为氧化还原反应
;(3)写出反应⑦的化学方程式
3Fe+4H2O
Fe3O4+4H2↑
| ||
3Fe+4H2O
Fe3O4+4H2↑
;
| ||
(4)写出过量A与H浓溶液反应的离子方程式
Fe+4H++2NO3-=Fe2++2NO2↑+2H2O
Fe+4H++2NO3-=Fe2++2NO2↑+2H2O
;(5)D是实验中常用的物质,检验D是否变质的方法是:
取少量样品于试管中,加入KSCN溶液,如果出现红色,说明变质;反之,没有变质
取少量样品于试管中,加入KSCN溶液,如果出现红色,说明变质;反之,没有变质
.分析:根据“B极易分解冷却时分解产物又能化合生成B”等信息可判断B是NH4Cl,再根据“E、F都是气体”“E可以连续两发生被氧化”等信息可判断E是NH3、F是NO2、进而可判断C是H2O、H是HNO3,A为金属,所以X为H2,C为水与金属A在高温下反应可生成H2,则A为Fe,D为FeCl2,Y为FeCl3,反应⑤为FeCl2和浓HNO3的反应,结合物质的性质解答该题.
解答:解:根据“B极易分解冷却时分解产物又能化合生成B”等信息可判断B是NH4Cl,再根据“E、F都是气体”“E可以连续两发生被氧化”等信息可判断E是NH3、F是NO2、进而可判断C是H2O、H是HNO3,A为金属,所以X为H2,C为水与金属A在高温下反应可生成H2,则A为Fe,D为FeCl2,Y为FeCl3,反应⑤为FeCl2和浓HNO3的反应,则
(1)B是NH4Cl,为离子化合物,电子式为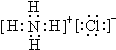 ,故答案为:
,故答案为: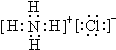 ;
;
(2)以上反应①~④、⑥~⑦中都有单质参加反应,并生成化合物,为氧化还原反应,反应⑤为FeCl2和浓HNO3的反应,也为氧化还原反应,则均为氧化还原反应,
故答案为:均为氧化还原反应;
(3)反应⑦为Fe和水在高温下的反应,方程式为3Fe+4H2O
Fe3O4+4H2↑,
故答案为:3Fe+4H2O
Fe3O4+4H2↑;
(4)过量Fe与HNO3浓溶液反应,生成Fe2+和NO2,反应的离子方程式为Fe+4H++2NO3-=Fe2++2NO2↑+2H2O,
故答案为:Fe+4H++2NO3-=Fe2++2NO2↑+2H2O;
(5)D为FeCl2,具有还原性,易被氧化生成FeCl3,可通过KSCN与Fe3+反应溶液呈红色的现象判断是否变质,方法是取少量样品于试管中,加入KSCN溶液,如果出现红色,说明变质;反之,没有变质,
故答案为:取少量样品于试管中,加入KSCN溶液,如果出现红色,说明变质;反之,没有变质.
(1)B是NH4Cl,为离子化合物,电子式为
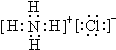 ,故答案为:
,故答案为: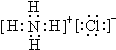 ;
;(2)以上反应①~④、⑥~⑦中都有单质参加反应,并生成化合物,为氧化还原反应,反应⑤为FeCl2和浓HNO3的反应,也为氧化还原反应,则均为氧化还原反应,
故答案为:均为氧化还原反应;
(3)反应⑦为Fe和水在高温下的反应,方程式为3Fe+4H2O
| ||
故答案为:3Fe+4H2O
| ||
(4)过量Fe与HNO3浓溶液反应,生成Fe2+和NO2,反应的离子方程式为Fe+4H++2NO3-=Fe2++2NO2↑+2H2O,
故答案为:Fe+4H++2NO3-=Fe2++2NO2↑+2H2O;
(5)D为FeCl2,具有还原性,易被氧化生成FeCl3,可通过KSCN与Fe3+反应溶液呈红色的现象判断是否变质,方法是取少量样品于试管中,加入KSCN溶液,如果出现红色,说明变质;反之,没有变质,
故答案为:取少量样品于试管中,加入KSCN溶液,如果出现红色,说明变质;反之,没有变质.
点评:本题考查无机物的推断,题目难度中等,明确物质的种类为解答该题的关键,注意根据物质的反应现象、特性作为推断的突破口.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
| |||||||||||||||||||||||




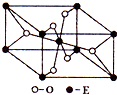 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.