网址:http://m.1010jiajiao.com/timu3_id_56085[举报]
(1)如图1表示金刚石、石墨在相关反应过程中的能量变化关系.写出石墨转化为金刚石的热化学方程式

(2)CO与H2可在一定条件下反应生成燃料甲醇:CO(g)+2H2(g)?CH3OH(g)△H<0
将2molCO和4molH2置于一体积不变的1L密闭容器中,测定不同条件、不同时间段内CO的转化率,得到下表数据.
| 时间 \CO转化率 \温度 |
1小时 | 2小时 | 3小时 | 4小时 |
| T1 | 30% | 50% | 80% | 80% |
| T2 | 35% | 60% | a1 | a2 |
a1、a2、80%三者的大小关系为
A.反应在2小时的时候混合气体的密度和相对分子质量均比l小时的大B.反应在3小时的时候,v正(H2)=2v逆(CH30H)
C.若其他条件不变,再充入6molH2,则最多可得到64g CH3OH
D.其他条件不变,若最初加入的H2为2.4mol,则达平衡时CO的转化率为50%
(3)工业中常用以下反应合成氨:N2+3H2?2NH3△H<0.在三个不同条件的密闭容 器中,分别加入浓度均为c(N2)=0.10mol/L,c(H2)=0.30mol/L进行反应时,N2的浓度随时间的变化如图2中的①、②、③曲线所示.
计算③中产物NH3在0-10min的平均反应速率
研究碳及其化合物的性质对促进低碳社会的构建具有重要意义。
(1)将不同量的CO(g)和H2O(g)分别通人体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)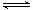 CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
|
实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
|
2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以CO2表示的反应速率为_____________(保留2位小数);
②该反应为___________(填“吸热”或“放热”)反应;
③实验2的平衡常数为___________________________。
(2)已知在常温常压下:
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1451.6kJ/mol
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
写出甲醇不完全燃烧生成CO和液态水的热化学方程式_______________________________。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除去(Co3+的还原产物是CO2+)。
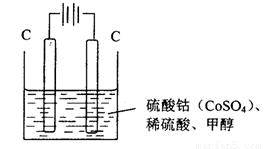
①写出阳极电极反应式_______________________________________________________________ ;
②写出除去甲醇的离子方程式__________________________________________________________。
查看习题详情和答案>>
研究氮及其化合物具有重要意义。请回答下列问题:
(1)脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g) +NO(g) +NO2(g) 2N2(g)
+3H2O(g) △H<0,反应的氧化剂是________________。
2N2(g)
+3H2O(g) △H<0,反应的氧化剂是________________。
(2)巳知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。
N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。
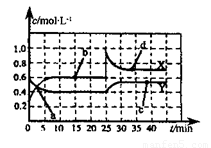
(3)25℃时,将NH3溶于水得100 mL0.1 mol • L-1的氨水,测得pH=11,则该条件下,NH3 • H2O的电离平衡常数Kb=_______。
(4)已知:N2(g)+O2(g)=2NO(g) △H=+180kJ/mol;
2NO(g)+O2(g)=2NO2(g) △H=-112kJ/mol;
2C(s)+O2(g)=2CO(g) △H=-221kJ/mol;
C(s)+O2(g)=CO2 (g) △H=-393.5kJ/mol。
则反应4CO(g)+2NO2(g)=4CO2 (g)+ N2(g) △H=________。
(5)用电化学法可获得N2O5。如图装置中,阳极的电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+,则该电解反应的化学方程式为________________。

查看习题详情和答案>>
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g);ΔH1=+489.0 kJ·mol-1
C(s)+CO2(g)=2CO(g);ΔH2=+172.5 kJ·mol-1。
则CO还原Fe2O3的热化学方程式为________________________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题: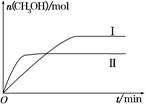
①该反应的平衡常数的表达式为K=________。
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“大于”、“等于”或“小于”)。
③在下图a、b、c三点中,H2的转化率由高到低的顺序是________(填字母)。
(3)在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是________(填序号)。
a.氢气的浓度减小
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义.
(1)NO2可用水吸收,相应的化学反应方程式为______.利用反应6NO2(g)+8NH3(g)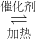 7N2(g)+12H2O(g)也可处理NO2.则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是______L.
7N2(g)+12H2O(g)也可处理NO2.则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是______L.
(2)汽车尾气中含有NO和CO气体,对环境有影响.已知平衡常数K的值大小,是衡量化学反应进行程度的标志.在25℃时,下列反应及平衡常数如下
2NO(g)?N2(g)+O2(g)-Q1 K1=1×1030
2CO(g)+O2(g)?2CO2(g)+Q2 K2=2.5×1091
为了完成汽车尾气处理装置的改造,除去氮氧化物、一氧化碳污染气体,根据上述有关数据判断,下列说法正确的是______
A.改造后的尾气装置使用高温高压,可大量减少污染气体的排放
B.汽车尾气中氮氧化物在空气中会自动的转化为氮肥,对植物生长有益,可不必除去
C.改造后的尾气装置使用催化剂,可大量减少污染气体的排放
D.根据K1和K2的数据,尾气中NO和CO可自行转化为无害气体
(3)一定条件下将CO和H2O发生反应,可减少CO对环境的影响.若在700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2+H2(g)
反应过程中测定的部分数据见下表(表中t1<t2):
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
(4)酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标.某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |