题目内容
研究碳及其化合物的性质对促进低碳社会的构建具有重要意义。
(1)将不同量的CO(g)和H2O(g)分别通人体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)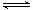 CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
|
实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
|
2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以CO2表示的反应速率为_____________(保留2位小数);
②该反应为___________(填“吸热”或“放热”)反应;
③实验2的平衡常数为___________________________。
(2)已知在常温常压下:
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1451.6kJ/mol
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
写出甲醇不完全燃烧生成CO和液态水的热化学方程式_______________________________。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除去(Co3+的还原产物是CO2+)。
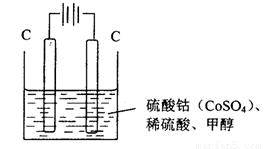
①写出阳极电极反应式_______________________________________________________________ ;
②写出除去甲醇的离子方程式__________________________________________________________。
(12分)(1)①0.13mol/(L•min)(2分) ②放热(1分)
③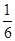 (2分)
(2分)
(2)CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-442.8kJ/mol (3分,方程式2分,数值1分)
(3)①Co2+-e-=Co3+(2分) ②6Co3++CH3OH+H2O=CO2↑+6Co2++6H+(2分)
【解析】
试题分析:(1)①根据表中数据可知,氢气的物质的量变化量为1.6mol,因此根据反应的方程式可知,CO2的变化量也是1.6mol,其浓度是1.6mol÷2L=0.8mol/L,所以CO2表示的反应速率是v(CO2)=0.8mol/L÷6min=0.13mol/(L•min)。
②根据表中数据可知,实验1中CO的转化率为 ×100%=40%,实验2中CO的转化率为
×100%=40%,实验2中CO的转化率为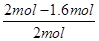 ×100%=20%,因此实验1的转化率大于实验2。这说明温度升高平衡向逆反应方向移动,因此正反应放热。
×100%=20%,因此实验1的转化率大于实验2。这说明温度升高平衡向逆反应方向移动,因此正反应放热。
③平衡时CO的物质的量为1.6mol÷2L=0.8mol/L,则:
CO(g)+H2O(g)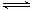 CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 1 0.5 0 0
转化浓度(mol/L) 0.2 0.2 0.2 0.2
平衡浓度(mol/L) 0.8 0.3 0.2 0.2
化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值.所以900℃时该反应平衡常数K=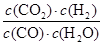 =
=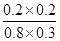 =0.17。
=0.17。
(2)已知反应①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1451.6kJ/mol和反应②2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol,则根据盖斯定律可知,(①-②)÷2即得CH3OH(l)+O2(g)=CO(g)+2H2O(l),所以该反应的反应热△H=(-1451.6kJ/mol+566.0kJ/mol)÷2=-442.8kJ/mol。
(3)①电解池中阳极失去电子,发生氧化反应。因此通电后,Co2+在阳极失去电子氧化成Co3+,所以阳极电极反应式为Co2+-e-=Co3+。
②以Co3+做氧化剂把水中的甲醇氧化成CO2而除去,自身被还原为Co2+,结合原子守恒与电荷守恒可知,该反应的离子方程式为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
考点:考查化学平衡、化学反应速率、平衡常数的计算;热化学方程式的书写;原电池和电解池的工作原理以及氧化还原反应方程式的书写等

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
 (1)工业上可利用反应Na(1)+ KCl(1)
K(g)+ NaCl(1)来治炼金属钾,此反应利用了钠的还原性及___
_____,
(1)工业上可利用反应Na(1)+ KCl(1)
K(g)+ NaCl(1)来治炼金属钾,此反应利用了钠的还原性及___
_____,