网址:http://m.1010jiajiao.com/timu3_id_55226[举报]
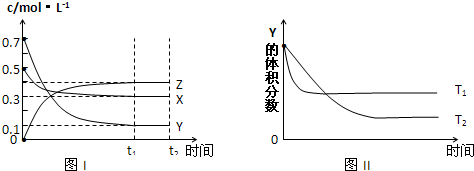
某温度时,在体积为1L的密闭容器中,A、B、C三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,B的体积百分含量与时间关系如图II所示。则下列结论正确的是

A.该反应的热化学方程式为 :A(g )+3B(g)![]() 2C(g) ;△H>0
2C(g) ;△H>0
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,若其他条件不变,减小体积,平衡向正反应方向移动
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率减小
查看习题详情和答案>>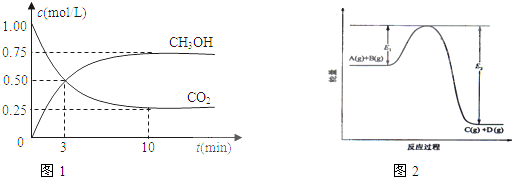
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=
(2)该反应的平衡常数表达式为
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
(3)如果在达平衡后某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡
a.向正反应方向移动 b.向逆反应方向移动 c.不移动 d.无法确定平衡移动方向
(4)下列措施中能使
| n(CH3OH) |
| n(CO2) |
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(5)在反应体系中加入催化剂,E1和E2的变化是:E1
 在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.请回答下列问题:
在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.请回答下列问题:(1)700℃时,0-5min内,以B表示的平均反应速率为
(2)能判断该反应是否达到化学平衡状态的依据是(多选扣分)
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c (c)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=
(4)800℃时,某时刻测得体系中各物质的物质的量浓度如下:c(A)=0.06mol?L-1,c(B)=0.50mol?L-1,c(C)=0.20mol?L-1,c(D)=0.018mol?L-1,则此时该反应
在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g) ![]() C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。请回答下列问题:
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。请回答下列问题:

(1)700℃时,0―5min内,以B表示的平均反应速率为____________________________。
(2)能判断该反应是否达到化学平衡状态的依据是(多选扣分)__________________。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)= c (c)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常
数K=_______________,该反应为__________反应(填“吸热”或“放热”)。
(4)800℃时,某时刻测得体系中各物质的物质的量浓度如下:c(A)=0.06mol?L-1,c(B)=0.50mol?L-1,c(C)=0.20mol?L-1,c(D)=0.018mol?L-1,则此时该反应______________(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
查看习题详情和答案>>