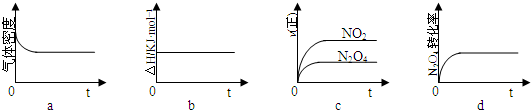题目内容
在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);测得CO2和CH3OH(g)的浓度随时间变化如图1所示.该反应过程中的能量变化如图2所示.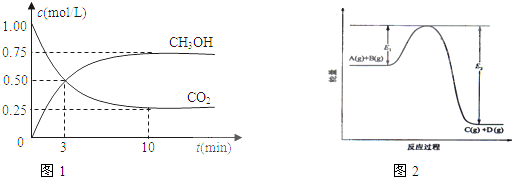
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=
(2)该反应的平衡常数表达式为
(3)如果在达平衡后某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡
a.向正反应方向移动 b.向逆反应方向移动 c.不移动 d.无法确定平衡移动方向
(4)下列措施中能使
增大的是
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(5)在反应体系中加入催化剂,E1和E2的变化是:E1

(1)从反应开始到平衡,氢气的平均反应速率v(H2)=
0.225
0.225
mol/(L?min).(2)该反应的平衡常数表达式为
K=
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
K=
.该条件下的平衡常数K=| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
5.33
5.33
(可用分数表示),温度升高,K值减少
减少
(填“增大”“不变”或者“减少”)(3)如果在达平衡后某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡
b
b
(填写序号).a.向正反应方向移动 b.向逆反应方向移动 c.不移动 d.无法确定平衡移动方向
(4)下列措施中能使
| n(CH3OH) |
| n(CO2) |
CD
CD
.A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(5)在反应体系中加入催化剂,E1和E2的变化是:E1
减小
减小
,E2减小
减小
(填“增大”“减小、”“不变”).对反应热是否有影响?无
无
,原因是催化剂不能改变反应物的总能量与生成物总能量的差值,即反应热不变
催化剂不能改变反应物的总能量与生成物总能量的差值,即反应热不变
.分析:(1)由图可知,平衡时二氧化碳的浓度变化量为1mol/L-0.25mol/L=0.75mol/L,根据v=
计算v(CO2),再利用速率之比等于化学计量数之比计算v(H2);
(2)根据反应方程式和平衡常数的概念书写K的表达式;利用三段式计算出反应混合物各组分的平衡时的浓度,代入平衡常数表达式计算;升高温度平衡向吸热反应方向移动,结合热效应判断平衡移动方向,据此分析平衡常数的变化;
(3)计算出平衡时各物质的浓度,根据平衡常数表达式计算;
(4)为使甲醇与二氧化碳的物质的量比值增大,应使平衡向正反应方向移动,或增加甲醇的物质的量;
(5)加入催化剂降低反应的活化能,反应热不变;
| △c |
| △t |
(2)根据反应方程式和平衡常数的概念书写K的表达式;利用三段式计算出反应混合物各组分的平衡时的浓度,代入平衡常数表达式计算;升高温度平衡向吸热反应方向移动,结合热效应判断平衡移动方向,据此分析平衡常数的变化;
(3)计算出平衡时各物质的浓度,根据平衡常数表达式计算;
(4)为使甲醇与二氧化碳的物质的量比值增大,应使平衡向正反应方向移动,或增加甲醇的物质的量;
(5)加入催化剂降低反应的活化能,反应热不变;
解答:解:(1)由图可知,10min到达平衡时二氧化碳的浓度变化量为1mol/L-0.25mol/L=0.75mol/L,
所以v(CO2)=
=0.075mol/(L?min),
速率之比等于化学计量数之比,
所以v(H2)=3v(CO2)=3×0.075mol/(L?min)=0.225mol/(L?min),
故答案为:0.225mol/(L?min);
(2)已知发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);则平衡常数表达式为:K=
,
平衡时二氧化碳的浓度为0.25mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
故500℃平衡常数k=
=5.33,
该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数k值减少,
故答案为:K=
;5.33,减少;
(3)只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,
则此时Qc=
=10>K,则平衡向逆反应方向移动,故选b,
故答案为:b;
(4)a、升高温度,平衡向逆反应方向移动,甲醇与二氧化碳的物质的量比值减小,故a错误;
b、充入He(g),使体系压强增大,但对反应物质没有影响,平衡不移动,二者比值不变,故b错误;
c、将H2O(g)从体系中分离,生成物的浓度减小,平衡向正反应方向移动,二者比值变大,故c正确;
d、再充入1mol CO2和3mol H2反应容器内压强增大,平衡状态与原平衡比较,要向正方向移动,甲醇浓度增大,二者比值增大,故d正确.
故答案为:cd;
(5)加入催化剂降低反应的活化能,所以E1和E2都减小,催化剂不能改变反应物的总能量与生成物总能量的差值,即反应热不变,
故答案为:减小;减小;无;催化剂不能改变反应物的总能量与生成物总能量的差值,即反应热不变.
所以v(CO2)=
| 0.75mol/L |
| 10min |
速率之比等于化学计量数之比,
所以v(H2)=3v(CO2)=3×0.075mol/(L?min)=0.225mol/(L?min),
故答案为:0.225mol/(L?min);
(2)已知发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);则平衡常数表达式为:K=
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
平衡时二氧化碳的浓度为0.25mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
故500℃平衡常数k=
| 0.75×0.75 |
| 0.25×0.753 |
该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数k值减少,
故答案为:K=
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
(3)只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,
则此时Qc=
| 0.8×0.8 |
| 1×0.43 |
故答案为:b;
(4)a、升高温度,平衡向逆反应方向移动,甲醇与二氧化碳的物质的量比值减小,故a错误;
b、充入He(g),使体系压强增大,但对反应物质没有影响,平衡不移动,二者比值不变,故b错误;
c、将H2O(g)从体系中分离,生成物的浓度减小,平衡向正反应方向移动,二者比值变大,故c正确;
d、再充入1mol CO2和3mol H2反应容器内压强增大,平衡状态与原平衡比较,要向正方向移动,甲醇浓度增大,二者比值增大,故d正确.
故答案为:cd;
(5)加入催化剂降低反应的活化能,所以E1和E2都减小,催化剂不能改变反应物的总能量与生成物总能量的差值,即反应热不变,
故答案为:减小;减小;无;催化剂不能改变反应物的总能量与生成物总能量的差值,即反应热不变.
点评:本题考查化学平衡的有关计算,催化剂对活化能和反应热的影响,本题难度不大,做题时注意平衡常数的计算和应用.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
 (2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池.
(2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池.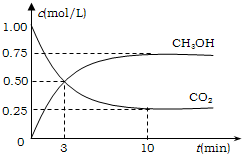 降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,先进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,先进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.