题目内容
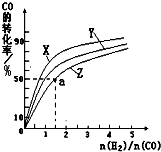
 在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.请回答下列问题:
在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.请回答下列问题:(1)700℃时,0-5min内,以B表示的平均反应速率为
(2)能判断该反应是否达到化学平衡状态的依据是(多选扣分)
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c (c)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=
(4)800℃时,某时刻测得体系中各物质的物质的量浓度如下:c(A)=0.06mol?L-1,c(B)=0.50mol?L-1,c(C)=0.20mol?L-1,c(D)=0.018mol?L-1,则此时该反应
| ||
| △t |
(2)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,以及由此衍生的其它一些物理量不变,可由此进行判断;
(3)先计算平衡时各物质的浓度,再根据K=
| c(C)×c(D) |
| c(A)×c2(B) |
升高温度,平衡向吸热反应方向移动,根据D物质的量的变化确定反应热;
(4)根据浓度商和化学平衡常数的相对大小判断,如果浓度商大于化学平衡常数,则反应向正反应方向移动,如果浓度商小于化学平衡常数,则反应向逆反应方向移动.
| ||
| 5min |
故答案为:0.18mol/(L.min);
(2)A.该反应是一个反应前后气体体积减小的可逆反应,当反应到达平衡状态时,容器中压强不变,所以能作为判断化学平衡的依据,故A正确;
B.反应到达平衡状态时,混合气体中c(A)不变,说明到达平衡,故B正确;
C.当2v正(B)=v逆(D)时,即v正(B):v逆(D)=1:2≠2:1,该反应不处于平衡状态,故C错误;
D.当c(A)=c(C)时,该反应不一定达到平衡状态,与反应物浓度及转化率有关,故D错误;
故选AB;
(3)反应达到平衡状态时,c(D)=0.6mol/L,c(C)=c(D)=0.6mol/L,c(A)=
| 1mol-0.6mol |
| 1L |
| 2.2mol-0.6mol×2 |
| 1L |
K=
| 0.6×0.6 |
| 0.4×12 |
升高温度,D的含量增大,说明平衡向正反应方向移动,则正反应是吸热反应,
故答案为:0.9;吸热;
(4)Qc=
| 0.2×0.018 |
| 0.06×0.52 |

 阅读快车系列答案
阅读快车系列答案(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
请完成并配平上述化学方程式.其中氧化剂是
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
①已知:CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为
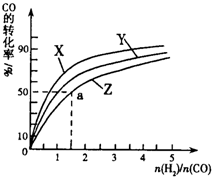
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.
请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数K=
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol?L-1)变化如下表所示:
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
____C+____K2Cr2O7 + =___CO2↑+ ____K2SO4 + ____Cr2(SO4)3+ ____H2O
请完成并配平上述化学方程式。
其中氧化剂是________________,氧化产物是_________________
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①已知: △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1
 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为 ;
②在容积为1L的恒容容器中,分别研究在230℃、250℃
270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
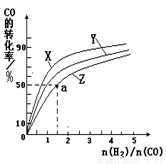
请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是 。
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g)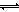 CH3OH(g)的平衡常数K=
。
CH3OH(g)的平衡常数K=
。
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
|
|
0min |
5min |
10min |
|
CO |
0.1 |
|
0.05 |
|
H2 |
0.2 |
|
0.2 |
|
CH3OH |
0 |
0.04 |
0.05 |
若5min~10min只改变了某一条件,所改变的条件是 ; 且该条件所改变的量是 。