摘要:3.2×103kg 本资料由 提供!
网址:http://m.1010jiajiao.com/timu3_id_54043[举报]
实验室配制 480mL 0.2mol/L CuSO4 溶液,实验操作步骤有:
①用天平称量蓝矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解;
②把制得的溶液小心地注入容量瓶中;
③继续向容量瓶中加蒸馏水至液面距刻度 1~2cm 处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒 2~3 次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞塞紧,充分摇匀.
请填写下列空白:
(1)在天平上称出蓝矾质量为
(2)本实验用到的玻璃仪器有
(3)操作步骤的正确顺序为
(4)若出现如下情况,所配溶液浓度将怎么变?(填“偏高”“偏低”或“无影响”).
①没有进行操作步骤④时,会
②加蒸馏水时不慎超过了刻度,会
③某同学俯视观察液面,对所配溶液浓度会
(5)若实验过程中出现如下情况应如何处理:
①加蒸馏水时不慎超过了刻度,应
②向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,应
查看习题详情和答案>>
①用天平称量蓝矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解;
②把制得的溶液小心地注入容量瓶中;
③继续向容量瓶中加蒸馏水至液面距刻度 1~2cm 处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒 2~3 次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞塞紧,充分摇匀.
请填写下列空白:
(1)在天平上称出蓝矾质量为
25.0g
25.0g
;(2)本实验用到的玻璃仪器有
烧杯、玻璃棒、500mL容量瓶、胶头滴管
烧杯、玻璃棒、500mL容量瓶、胶头滴管
.(3)操作步骤的正确顺序为
①②④③⑤
①②④③⑤
(填序号).(4)若出现如下情况,所配溶液浓度将怎么变?(填“偏高”“偏低”或“无影响”).
①没有进行操作步骤④时,会
偏低
偏低
;②加蒸馏水时不慎超过了刻度,会
偏低
偏低
.③某同学俯视观察液面,对所配溶液浓度会
偏高
偏高
(5)若实验过程中出现如下情况应如何处理:
①加蒸馏水时不慎超过了刻度,应
应倒掉溶液,洗涤容量瓶,重新配制
应倒掉溶液,洗涤容量瓶,重新配制
;②向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,应
应倒掉溶液,洗涤容量瓶,重新配制
应倒掉溶液,洗涤容量瓶,重新配制
. 实验室配制500mL0.5mol?L-1的NaOH溶液,有如下操作步骤:
实验室配制500mL0.5mol?L-1的NaOH溶液,有如下操作步骤:①把称好的NaOH放入小烧杯中.加入适量的蒸馏水溶解、冷却;
②把①所得溶液小心转入500mL容量瓶中;
③继续向容量瓶中加蒸馏水至液面距刻度线l~2cm处,改用胶头滴管小心加蒸馏水至溶液凹液面底部与刻度线相切;
④用少量蒸馏水洗涤烧杯2~3次,每次洗涤的液体都小心用同一玻璃棒引流转入容量瓶并轻轻摇匀;
⑤将容量瓶塞紧瓶塞,充分摇匀.
回答下列问题:
(1)要配制氢氧化钠溶液,在用托盘天平称量氢氧化钠固体时,托盘天平的读数是
A
A
(填代号,下同);A.10.0g B.10.00g C.>10.0gD.<10.0g
(2)本实验操作步骤的正确顺序是(填序号)
①②④③⑤
①②④③⑤
;(3)本实验用到的基本仪器除了天平、药匙、玻璃棒、烧杯以外,还需要的仪器有
胶头滴管、500mL容量瓶
胶头滴管、500mL容量瓶
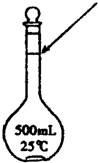
_;(4)某同学观察液面的情况如图所示,对所配溶液的物质的量浓度有何影响?
偏高
偏高
(填“偏高”、“偏低”或“无影响”);(5)在配制溶液的过程中,下列操作能造成结果偏低的是
B
B
.A.容量瓶不干燥,含有少量蒸馏水B.溶解所用的烧杯未洗涤
C.称量NaOH固体时,所用的砝码生锈D.定容后摇匀,发现液面低于刻度线.
(2010?海南)根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量Ar(Cu)(近似值)的实验.先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H20),由此计算Ar(Cu).为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→
(3)在本实验中,若测得m(CuO)=a g,m(H2O)=b g,则Ar(Cu)=
-16
-16;
(4)在本实验中,使测定结果Ar(Cu)偏大的是
①Cu0未完全起反应 ②CuO不干燥 ③Cu0中混有不反应的杂质 ④碱石灰不干燥 ⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定
查看习题详情和答案>>

请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为
2NH3+3CuO
3Cu+3H2O+N2
| ||
2NH3+3CuO
3Cu+3H2O+N2
;
| ||
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→
e→b→e
e→b→e
;(3)在本实验中,若测得m(CuO)=a g,m(H2O)=b g,则Ar(Cu)=
| 18a |
| b |
| 18a |
| b |
(4)在本实验中,使测定结果Ar(Cu)偏大的是
①③
①③
(填序号);①Cu0未完全起反应 ②CuO不干燥 ③Cu0中混有不反应的杂质 ④碱石灰不干燥 ⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定
m(CuO)
m(CuO)
和m(Cu)
m(Cu)
,或m(Cu)
m(Cu)
和m(H2O)
m(H2O)
达到实验目的.实验需498mL0.200mol/L的CuSO4溶液,实验室用胆矾晶体配制溶液,请填写下列空白:
(1)需称取胆矾晶体 g;
(2)本实验用到的基本仪器已有烧杯、天平(砝码、镊子)、药匙,还缺少的仪器是 、 、 ;
(3)下列情况会使所配溶液浓度偏低的是(填序号) .
a.定容时俯视 b.未洗涤烧杯
c.加蒸馏水时,不慎超过了刻度线
d.称量时物品和砝码位置放反(1g以下用游码)
e.将胆矾改成16.0g无水CuSO4配制.
查看习题详情和答案>>
(1)需称取胆矾晶体
(2)本实验用到的基本仪器已有烧杯、天平(砝码、镊子)、药匙,还缺少的仪器是
(3)下列情况会使所配溶液浓度偏低的是(填序号)
a.定容时俯视 b.未洗涤烧杯
c.加蒸馏水时,不慎超过了刻度线
d.称量时物品和砝码位置放反(1g以下用游码)
e.将胆矾改成16.0g无水CuSO4配制.
(2013?上海二模)某实验小组设计了下列装置进行氨的催化氧化实验.
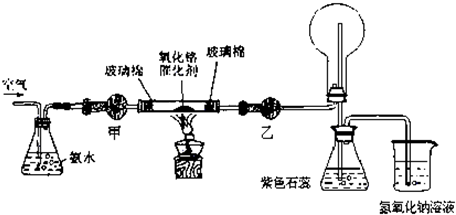
(1)常温下,氨水的浓度为1:1.5(28%的浓氨水和水的体积比)时实验现象明显,配制该浓度氨水的玻璃仪器有
(2)本实验用的干燥剂是碱石灰和无水氯化钙.则甲处是
(3)实验时,先将催化剂加热至红热,在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明反应是
(4)实验前,烧杯中盛有200mL 1.000mol/L的 NaOH溶液,实验后测得烧杯中溶液的pH=13,且溶液质量比反应前增加了7.48g,则NaOH溶液吸收的NO和NO2的物质的量之比是
(5)实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中产生白烟.其原因可用化学方程式表示为:
(6)已知NH3和N2常压下的沸点分别为:-33.5℃和-195.8℃,据此推测这两种物质中,能做制冷剂的是
查看习题详情和答案>>

(1)常温下,氨水的浓度为1:1.5(28%的浓氨水和水的体积比)时实验现象明显,配制该浓度氨水的玻璃仪器有
量筒、烧杯、玻璃棒
量筒、烧杯、玻璃棒
.(2)本实验用的干燥剂是碱石灰和无水氯化钙.则甲处是
碱石灰
碱石灰
;乙处是无水氯化钙
无水氯化钙
.(3)实验时,先将催化剂加热至红热,在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明反应是
放
放
(填“吸”或“放”)热反应;化学方程式为4NH3+5O2
4NO+6H2O
| ||
| 加热 |
4NH3+5O2
4NO+6H2O
.
| ||
| 加热 |
(4)实验前,烧杯中盛有200mL 1.000mol/L的 NaOH溶液,实验后测得烧杯中溶液的pH=13,且溶液质量比反应前增加了7.48g,则NaOH溶液吸收的NO和NO2的物质的量之比是
5:13
5:13
(设溶液的体积不变且忽略盐类的水解).(5)实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中产生白烟.其原因可用化学方程式表示为:
4NO+3O2+2H2O=4HNO3或2NO+O2=2NO2和3NO2+H2O=2HNO3+NO
或4NO2+O2+2H2O=4HNO3;
或4NO2+O2+2H2O=4HNO3;
4NO+3O2+2H2O=4HNO3或2NO+O2=2NO2和3NO2+H2O=2HNO3+NO
或4NO2+O2+2H2O=4HNO3;
、或4NO2+O2+2H2O=4HNO3;
NH3+HNO3=NH4NO3
NH3+HNO3=NH4NO3
.(6)已知NH3和N2常压下的沸点分别为:-33.5℃和-195.8℃,据此推测这两种物质中,能做制冷剂的是
NH3
NH3
(填分子式);能用来冷冻物质的是N2
N2
(填分子式).