��Ŀ����
��2013?�Ϻ���ģ��ijʵ��С�����������װ�ý��а��Ĵ�����ʵ�飮
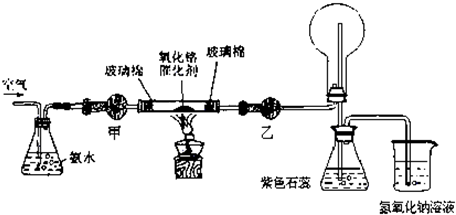
��1�������£���ˮ��Ũ��Ϊ1��1.5��28%��Ũ��ˮ��ˮ������ȣ�ʱʵ���������ԣ����Ƹ�Ũ�Ȱ�ˮ�IJ���������
��2����ʵ���õĸ�����Ǽ�ʯ�Һ���ˮ�Ȼ��ƣ���״���
��3��ʵ��ʱ���Ƚ��������������ȣ��ڲ��Ϲ������������£�Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵����Ӧ��
��4��ʵ��ǰ���ձ���ʢ��200mL 1.000mol/L�� NaOH��Һ��ʵ������ձ�����Һ��pH=13������Һ�����ȷ�Ӧǰ������7.48g����NaOH��Һ���յ�NO��NO2�����ʵ���֮����
��5��ʵ��ʱ���֣����ȱ���Ҵ��ĸ���ܣ�����Ӧ�������ֱ��ͨ����ƿ������ƿ�в������̣���ԭ����û�ѧ����ʽ��ʾΪ��
��6����֪NH3��N2��ѹ�µķе�ֱ�Ϊ��-33.5���-195.8�棬�ݴ��Ʋ������������У��������������

��1�������£���ˮ��Ũ��Ϊ1��1.5��28%��Ũ��ˮ��ˮ������ȣ�ʱʵ���������ԣ����Ƹ�Ũ�Ȱ�ˮ�IJ���������
��Ͳ���ձ���������
��Ͳ���ձ���������
����2����ʵ���õĸ�����Ǽ�ʯ�Һ���ˮ�Ȼ��ƣ���״���
��ʯ��
��ʯ��
���Ҵ�����ˮ�Ȼ���
��ˮ�Ȼ���
����3��ʵ��ʱ���Ƚ��������������ȣ��ڲ��Ϲ������������£�Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵����Ӧ��
��
��
��������š����ȷ�Ӧ����ѧ����ʽΪ4NH3+5O2
4NO+6H2O
| ||
| ���� |
4NH3+5O2
4NO+6H2O
��
| ||
| ���� |
��4��ʵ��ǰ���ձ���ʢ��200mL 1.000mol/L�� NaOH��Һ��ʵ������ձ�����Һ��pH=13������Һ�����ȷ�Ӧǰ������7.48g����NaOH��Һ���յ�NO��NO2�����ʵ���֮����
5��13
5��13
������Һ����������Һ��������ˮ�⣩����5��ʵ��ʱ���֣����ȱ���Ҵ��ĸ���ܣ�����Ӧ�������ֱ��ͨ����ƿ������ƿ�в������̣���ԭ����û�ѧ����ʽ��ʾΪ��
4NO+3O2+2H2O=4HNO3��2NO+O2=2NO2��3NO2+H2O=2HNO3+NO
��4NO2+O2+2H2O=4HNO3��
��4NO2+O2+2H2O=4HNO3��
4NO+3O2+2H2O=4HNO3��2NO+O2=2NO2��3NO2+H2O=2HNO3+NO
��4NO2+O2+2H2O=4HNO3��
����4NO2+O2+2H2O=4HNO3��
NH3+HNO3=NH4NO3
NH3+HNO3=NH4NO3
����6����֪NH3��N2��ѹ�µķе�ֱ�Ϊ��-33.5���-195.8�棬�ݴ��Ʋ������������У��������������
NH3
NH3
�������ʽ�����������䶳���ʵ���N2
N2
�������ʽ������������1����ˮ��Ũ��Ϊ1��1.5���������Ũ�ȣ�������ȡ��Һ�����ϵõ���������Һ���ƵĹ��̺Ͳ�������ж���Ҫ�IJ���������
��2���״��Ǹ��ﰱ����Ҫ�ü�ʯ�ң��Ҵ��Ǹ���һ�������������Ȼ��ƣ������������Ȼ��Ƹ��
��3�������Ĵ���������һ��������ˮ����Ӧ�Ƿ��ȷ�Ӧ��
��4������һ�������Ͷ�������������������Һ�������ɵ��η����жϣ�NaNO2��NaNO3����֪��Ԫ�غ͵�Ԫ���غ㣬���������ʽ����õ���
��5��ȱ���Ҵ��ĸ���ܣ�����Ӧ�������ֱ��ͨ����ƿ������ƿ�в������̣�����Ϊ��������Ϳ������ͨ��ˮ�з�Ӧ�����������������������粒���С������
��6���е�͵�������������������������������䶳���ʷе�ߵ�Һ����������䶳���ʵ����ʣ�
��2���״��Ǹ��ﰱ����Ҫ�ü�ʯ�ң��Ҵ��Ǹ���һ�������������Ȼ��ƣ������������Ȼ��Ƹ��
��3�������Ĵ���������һ��������ˮ����Ӧ�Ƿ��ȷ�Ӧ��
��4������һ�������Ͷ�������������������Һ�������ɵ��η����жϣ�NaNO2��NaNO3����֪��Ԫ�غ͵�Ԫ���غ㣬���������ʽ����õ���
��5��ȱ���Ҵ��ĸ���ܣ�����Ӧ�������ֱ��ͨ����ƿ������ƿ�в������̣�����Ϊ��������Ϳ������ͨ��ˮ�з�Ӧ�����������������������粒���С������
��6���е�͵�������������������������������䶳���ʷе�ߵ�Һ����������䶳���ʵ����ʣ�
����⣺��1����ˮ��Ũ��Ϊ1��1.5���������Ũ�ȣ�������ȡ��Һ�����ϵõ���������Ͳ��ȡ��ˮ��ˮ���ձ��л�Ϻ��ò���������õ����Ƶ���Һ��
�ʴ�Ϊ����Ͳ���ձ�����������
��2���״��Ǹ��ﰱ����Ҫ�ü�ʯ�ң���ֹˮ�������벣����ը�Ѳ����ܣ��Ҵ��Ǹ���һ�������������Ȼ��ƣ������պ��ٺ���װ�û����ɰ��̣������������Ȼ��Ƹ���״�����ʯ�ң��Ҵ�����ˮ�Ȼ��ƣ�
�ʴ�Ϊ����ʯ�ң��Ȼ��ƣ�
��3��ʵ��ʱ���Ƚ��������������ȣ��ڲ��Ϲ������������£�Ϩ��ƾ��ƣ���Ӧ���ܼ������У���Ӧ�Ƿ��ȷ�Ӧ���������ǰ����Ĵ�������Ӧ����һ��������ˮ����Ӧ�Ļ�ѧ����ʽΪ��4NH3+5O2
4NO+6H2O
�ʴ�Ϊ�����ȷ�Ӧ�� 4NH3+5O2
4NO+6H2O��
��4��ʵ��ǰ���ձ���ʢ��200mL 1.000mol/L�� NaOH��Һ��ʵ������ձ�����Һ��pH=13������������Ũ��Ϊ0.1mol/L������Һ�����ȷ�Ӧǰ������7.48gΪһ�������Ͷ������� �������������������������ʵ���=0.2L��1mol/L-0.1mol/L��0.2L=0.18mol����NO���ʵ���Ϊx��NO2���ʵ���Ϊy���õ���
x+y=0.18
28x+46y=7.48
���x=0.05mol��y=0.13mol
NO��NO2�����ʵ���֮��=0.05��0.13=5��13��
�ʴ�Ϊ��5��13��
��5�����ȱ���Ҵ��ĸ���ܣ�����Ӧ�������ֱ��ͨ����ƿ������ƿ�в������̣���������������һ��������һ�������Ϳ����е�������Ӧ���ɶ���������ͨ��ˮ�з�Ӧ�������ᣬ��������İ�����Ӧ��������粒���С������ð���̣���Ӧ�ĺ��Ҹ��³���Ϊ��4NO+3O2+2H2O=4HNO3����2NO+O2=2NO2��3NO2+H2O=2HNO3+NO��4NO2+O2+2H2O=4HNO3��NH3+HNO3=NH4NO3
�ʴ�Ϊ��4NO+3O2+2H2O��4HNO3����2NO+O2��2NO2��3NO2+H2O��2HNO3+NO
��4NO2+O2+2H2O��4HNO3��NH3+HNO3��NH4NO3
��6���е�͵�������������������������������䶳���ʷе�ߵ�Һ����������䶳���ʵ����ʣ���֪NH3��N2��ѹ�µķе�ֱ�Ϊ��-33.5���-195.8�棬�ݴ��Ʋ������������У�������������ǰ������������䶳���ʵ��ǵ���
�ʴ�Ϊ��NH3��N2��
�ʴ�Ϊ����Ͳ���ձ�����������
��2���״��Ǹ��ﰱ����Ҫ�ü�ʯ�ң���ֹˮ�������벣����ը�Ѳ����ܣ��Ҵ��Ǹ���һ�������������Ȼ��ƣ������պ��ٺ���װ�û����ɰ��̣������������Ȼ��Ƹ���״�����ʯ�ң��Ҵ�����ˮ�Ȼ��ƣ�
�ʴ�Ϊ����ʯ�ң��Ȼ��ƣ�
��3��ʵ��ʱ���Ƚ��������������ȣ��ڲ��Ϲ������������£�Ϩ��ƾ��ƣ���Ӧ���ܼ������У���Ӧ�Ƿ��ȷ�Ӧ���������ǰ����Ĵ�������Ӧ����һ��������ˮ����Ӧ�Ļ�ѧ����ʽΪ��4NH3+5O2
| ||
| ���� |
�ʴ�Ϊ�����ȷ�Ӧ�� 4NH3+5O2
| ||
| ���� |
��4��ʵ��ǰ���ձ���ʢ��200mL 1.000mol/L�� NaOH��Һ��ʵ������ձ�����Һ��pH=13������������Ũ��Ϊ0.1mol/L������Һ�����ȷ�Ӧǰ������7.48gΪһ�������Ͷ������� �������������������������ʵ���=0.2L��1mol/L-0.1mol/L��0.2L=0.18mol����NO���ʵ���Ϊx��NO2���ʵ���Ϊy���õ���
x+y=0.18
28x+46y=7.48
���x=0.05mol��y=0.13mol
NO��NO2�����ʵ���֮��=0.05��0.13=5��13��
�ʴ�Ϊ��5��13��
��5�����ȱ���Ҵ��ĸ���ܣ�����Ӧ�������ֱ��ͨ����ƿ������ƿ�в������̣���������������һ��������һ�������Ϳ����е�������Ӧ���ɶ���������ͨ��ˮ�з�Ӧ�������ᣬ��������İ�����Ӧ��������粒���С������ð���̣���Ӧ�ĺ��Ҹ��³���Ϊ��4NO+3O2+2H2O=4HNO3����2NO+O2=2NO2��3NO2+H2O=2HNO3+NO��4NO2+O2+2H2O=4HNO3��NH3+HNO3=NH4NO3
�ʴ�Ϊ��4NO+3O2+2H2O��4HNO3����2NO+O2��2NO2��3NO2+H2O��2HNO3+NO
��4NO2+O2+2H2O��4HNO3��NH3+HNO3��NH4NO3
��6���е�͵�������������������������������䶳���ʷе�ߵ�Һ����������䶳���ʵ����ʣ���֪NH3��N2��ѹ�µķе�ֱ�Ϊ��-33.5���-195.8�棬�ݴ��Ʋ������������У�������������ǰ������������䶳���ʵ��ǵ���
�ʴ�Ϊ��NH3��N2��
���������⿼���˰���ʵ�����Ʊ���������֤�����������Ĵ�������Ӧ����������Լ�ѡ�������գ����̷�Ӧ��ѧ����ʽ����д����Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ