题目内容
(2010?海南)根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量Ar(Cu)(近似值)的实验.先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H20),由此计算Ar(Cu).为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→
(3)在本实验中,若测得m(CuO)=a g,m(H2O)=b g,则Ar(Cu)=
-16
-16;
(4)在本实验中,使测定结果Ar(Cu)偏大的是
①Cu0未完全起反应 ②CuO不干燥 ③Cu0中混有不反应的杂质 ④碱石灰不干燥 ⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定

请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为
2NH3+3CuO
3Cu+3H2O+N2
| ||
2NH3+3CuO
3Cu+3H2O+N2
;
| ||
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→
e→b→e
e→b→e
;(3)在本实验中,若测得m(CuO)=a g,m(H2O)=b g,则Ar(Cu)=
| 18a |
| b |
| 18a |
| b |
(4)在本实验中,使测定结果Ar(Cu)偏大的是
①③
①③
(填序号);①Cu0未完全起反应 ②CuO不干燥 ③Cu0中混有不反应的杂质 ④碱石灰不干燥 ⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定
m(CuO)
m(CuO)
和m(Cu)
m(Cu)
,或m(Cu)
m(Cu)
和m(H2O)
m(H2O)
达到实验目的.分析:(1)氨气具有弱还原性,在加热条件下可以被氧化铜氧化,生成氮气、铜和水;
(2)根据题干可知需测定生成水的质量,生成的氨气需先通过碱石灰干燥、再在与氧化铜反应,最后用碱石灰吸收生成的水,以测得生成水的质量;
(3)由反应方程式可知氧化铜和水的物质的量相等,列出关系式:
=
,求出铜元素相对原子质量Ar(Cu)=
-16,;
(4)根据Ar(Cu)=
-16,从是否影响a或b来分析误差;
(5)根据化学方程式可知也可以通过测定m(CuO)和m(Cu)或m(Cu)和m(H2O)来达到实验目的.
(2)根据题干可知需测定生成水的质量,生成的氨气需先通过碱石灰干燥、再在与氧化铜反应,最后用碱石灰吸收生成的水,以测得生成水的质量;
(3)由反应方程式可知氧化铜和水的物质的量相等,列出关系式:
| a |
| Ar(Cu)+16 |
| b |
| 18 |
| 18a |
| b |
(4)根据Ar(Cu)=
| 18a |
| b |
(5)根据化学方程式可知也可以通过测定m(CuO)和m(Cu)或m(Cu)和m(H2O)来达到实验目的.
解答:解:(1)氨气具有弱还原性,在加热条件下可以被氧化铜氧化,反应物为氮气、铜和水,反应的化学方程式为2NH3+3CuO
3Cu+3H2O+N2,故答案为:2NH3+3CuO
3Cu+3H2O+N2;
(2)因为需要测定反应后生成物水的质量,所以必需保证通入的氨气是纯净干燥的,由于浓硫酸可以与氨气反应,因此只能通过碱石灰进行干燥,再通入氧化铜进行反应,最后在通入碱石灰吸收反应生成的水,以测得生成水的质量,所以正确的顺序为a→e→b→e,故答案为:a→e→b→e;
(3)根据反应方程式2NH3+3CuO
3Cu+3H2O+N2;
3 3
可知氧化铜和水的物质的量相等,所以有以下关系式:
=
,
解得Ar(Cu)=
=
-16,故答案为:
-16;
(4)由(3)可知得Ar(Cu)=
-16,
①若Cu0未完全起反应,说明b偏小,结果偏大;
②若CuO不干燥,说明a偏小,b偏大,结果偏低;
③若Cu0中混有不反应的杂质,说明b偏小,结果偏大;
④若碱石灰不干燥,说明氨气干燥不彻底,b偏大,结果偏低;
⑤若NH4C1与Ca(OH)2混合物不干燥,但只要氨气干燥彻底,对结果不影响.
所以选项①③正确,故答案为:①③;
(5)根据反应方程式2NH3+3CuO
3Cu+3H2O+N2,可知也可以通过测定m(CuO)和m(Cu)或m(Cu)和m(H2O)来达到实验目的,故答案为:m(CuO)和m(Cu)、m(Cu)和m(H2O).
| ||
| ||
(2)因为需要测定反应后生成物水的质量,所以必需保证通入的氨气是纯净干燥的,由于浓硫酸可以与氨气反应,因此只能通过碱石灰进行干燥,再通入氧化铜进行反应,最后在通入碱石灰吸收反应生成的水,以测得生成水的质量,所以正确的顺序为a→e→b→e,故答案为:a→e→b→e;
(3)根据反应方程式2NH3+3CuO
| ||
3 3
可知氧化铜和水的物质的量相等,所以有以下关系式:
| a |
| Ar(Cu)+16 |
| b |
| 18 |
解得Ar(Cu)=
| 18a-16b |
| b |
| 18a |
| b |
| 18a |
| b |
(4)由(3)可知得Ar(Cu)=
| 18a |
| b |
①若Cu0未完全起反应,说明b偏小,结果偏大;
②若CuO不干燥,说明a偏小,b偏大,结果偏低;
③若Cu0中混有不反应的杂质,说明b偏小,结果偏大;
④若碱石灰不干燥,说明氨气干燥不彻底,b偏大,结果偏低;
⑤若NH4C1与Ca(OH)2混合物不干燥,但只要氨气干燥彻底,对结果不影响.
所以选项①③正确,故答案为:①③;
(5)根据反应方程式2NH3+3CuO
| ||
点评:本题主要考查氨气的制备、净化、干燥和利用方程式进行的计算以及有关误差分析,一定要认真、细致的分析问题.

练习册系列答案
相关题目

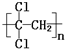 )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由