摘要:6.一定温度下.有可逆反应: △H<0.现将2molA和2molB充入体积为V的甲容器.将2molC和6molD充入体积为2V的乙容器.关于两容器中反应的说法正确的是( ). A.甲容器中的反应先达到化学平衡状态 B.在甲容器中再充入2molA和2molB.平衡向正反应方向移动.此时平衡常数增大 C.两容器达平衡后升高相同的温度.达到新的平衡.甲.乙容器中平衡混合物中各组分的体积分数不同 D.两容器中的反应均达平衡时.平衡混合物中各组分的体积分数相同.混合气体的平均相对分子质量也相同 座位号
网址:http://m.1010jiajiao.com/timu3_id_53967[举报]
如图所示的转化关系中,已知A是由短周期元素组成的酸式盐.D、Y、H为气体,X为无色液体,G和K均是常见的强酸.H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.

试回答下列问题:
(1)D的电子式为
 ;
;
(2)写出D+H+X→A的化学方程式:
(3)写出C→H的离子方程式:
(4)写出D与K反应生成的正盐的化学式:
(5)已知1mol H(g)完全转化为I(g)时放热98.3kJ,则此反应的热化学方程式为
(6)一定温度下,有可逆反应:aD(g)+bY(g)?cE(g)+dX(g).在2L密闭容器中,充入4mol D和5mol Y,有催化剂存在下,2min后反应达到平衡,测得平衡时容器内的压强比反应前增加了
.则前2min内用E表示的平均反应速率为
查看习题详情和答案>>

试回答下列问题:
(1)D的电子式为


(2)写出D+H+X→A的化学方程式:
NH3+SO2+H2O═NH4HSO3
NH3+SO2+H2O═NH4HSO3
;(3)写出C→H的离子方程式:
SO32-+2H+═SO2↑+H2O
SO32-+2H+═SO2↑+H2O
;(4)写出D与K反应生成的正盐的化学式:
(NH4)2SO4
(NH4)2SO4
;(5)已知1mol H(g)完全转化为I(g)时放热98.3kJ,则此反应的热化学方程式为
2SO2(g)+O2(g)=2SO3(g)△H=-196.6 kJ?mol-1
2SO2(g)+O2(g)=2SO3(g)△H=-196.6 kJ?mol-1
;某条件下,当加入4mol H和2mol Y后,放出314.56kJ的热时,此时H的转化率为80%
80%
;(6)一定温度下,有可逆反应:aD(g)+bY(g)?cE(g)+dX(g).在2L密闭容器中,充入4mol D和5mol Y,有催化剂存在下,2min后反应达到平衡,测得平衡时容器内的压强比反应前增加了
| 1 | 18 |
0.5
0.5
mol?L-1?min-1,平衡时D的浓度为1
1
mol?L-1.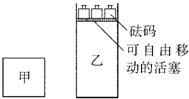 一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g);△H<0.现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图所示),保持反应过程中两容器的温度与起始时相同.下列说法正确的是( )
一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g);△H<0.现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图所示),保持反应过程中两容器的温度与起始时相同.下列说法正确的是( )| A、甲、乙两容器中的反应达到化学平衡时,两容器内压强相等 | B、甲、乙两容器中的反应达到化学平衡时,C的体积分数相等 | C、向甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度不变 | D、向乙容器中再充入2molC和6molD,平衡后乙中物质C的浓度为原来的2倍 |
 (2009?肇庆一模)一定温度下,有可逆反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2 (g)△H>0,以下说法中正确的是( )
(2009?肇庆一模)一定温度下,有可逆反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2 (g)△H>0,以下说法中正确的是( )