题目内容
 (2009?肇庆一模)一定温度下,有可逆反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2 (g)△H>0,以下说法中正确的是( )
(2009?肇庆一模)一定温度下,有可逆反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2 (g)△H>0,以下说法中正确的是( )分析:A.反应吸热,升高温度平衡向正反应方向移动;
B.该反应中,平衡常数仅为气体的浓度幂之积;
C.增大压强,正逆反应速率都增大,平衡不移动;
D.利用该反应原理可以在铁表面生成一层致密的Fe3O4.
B.该反应中,平衡常数仅为气体的浓度幂之积;
C.增大压强,正逆反应速率都增大,平衡不移动;
D.利用该反应原理可以在铁表面生成一层致密的Fe3O4.
解答:解:A.反应吸热,升高温度平衡向正反应方向移动,H2O(g)的转化率增大,故A正确;
B.反应的化学平衡常数的表达式为k=
,故B错误;
C.增大压强,正逆反应速率都增大,由于反应前后气体的化学计量数之和相等,则平衡不移动,故C错误;
D.利用该反应原理可以在铁表面生成一层致密的Fe3O4,起到保护层的作用,故D正确.
故选AD.
B.反应的化学平衡常数的表达式为k=
| c(H2)4 |
| c(H2O)4 |
C.增大压强,正逆反应速率都增大,由于反应前后气体的化学计量数之和相等,则平衡不移动,故C错误;
D.利用该反应原理可以在铁表面生成一层致密的Fe3O4,起到保护层的作用,故D正确.
故选AD.
点评:本题考查化学反应速率与化学平衡图象问题,题目难度中等,注意根据化学方程式的特点判断外界条件对平衡移动的影响.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
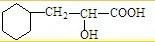
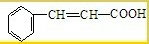
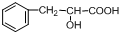 (2009?肇庆一模)有机物A是一种重要化工生产的中间体,其结构简式如下:
(2009?肇庆一模)有机物A是一种重要化工生产的中间体,其结构简式如下: