摘要:10.[答案]AC [分析预测及备考建议]离子共存问题.离子反应能否发生.离子方程式的书写.离子浓度大小的比较等问题是高考久考不衰的热点题型.不共存的可能有:
网址:http://m.1010jiajiao.com/timu3_id_52994[举报]
不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,x越大,其原子吸引电子的能力越强. 下面是某些短周期元素的x值:
(1)通过分析x值变化规律,确定Mg的x值范围:
(2)推测x值与原子半径的关系是
(3)分别指出下列两种化合物中氧元素的化合价:HClO
(4)经验规律告诉我们:当成键的两原子相应元素x数值的差值(△x),当△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键,试推断AlBr3中化学键类型是
(5)预测元素周期表中,x值最小的元素位于
查看习题详情和答案>>
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
0.93
0.93
<x(Mg)<1.57
1.57
.(2)推测x值与原子半径的关系是
同周期(同主族)中,x值大,其原子半径越小
同周期(同主族)中,x值大,其原子半径越小
;根据短周期元素的x值变化特点,体现了元素性质的周期性
周期性
变化规律.(3)分别指出下列两种化合物中氧元素的化合价:HClO
-2
-2
,HFO0
0
.(4)经验规律告诉我们:当成键的两原子相应元素x数值的差值(△x),当△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键,试推断AlBr3中化学键类型是
共价键
共价键
.(5)预测元素周期表中,x值最小的元素位于
第六
第六
周期第IA
第IA
族(放射性元素除外).硫酸亚铁铵又称莫尔盐,浅绿色晶体,在空气中比一般的亚铁盐稳定,溶于水但不溶于乙醇,化学式为[(NH4)2SO4?FeSO4?6H2O],相对分子质量为392,是常用的分析试剂.在实验室,将FeSO4和(NH4)2SO4两种溶液按一定比例混合,蒸发浓缩、冷却结晶,很容易得到硫酸亚铁铵晶体.某研究性学习小组已制备得到莫尔盐,准备分析研究他们得到的产品.请你帮助完成部分项目:
(1)预测现象:向盛有莫尔盐溶液的大试管中滴加浓NaOH溶液,并不断振荡.
(2)为了确定产品中亚铁含量,研究小组经查阅资料后,打算用KMnO4(酸化)溶液滴定莫尔盐溶液中的Fe2+.离子方程式为:5Fe2++MnO4-+8H+=5Fe2++Mn2++4H2O.滴定时必须选用的仪器有
(3)取莫尔盐产品23.520g,配成250mL溶液,取出25.00mL用0.0500mol/LKMnO4溶液滴定,消耗KMnO4溶液19.50mL,则产品中莫尔盐的质量分数
查看习题详情和答案>>
(1)预测现象:向盛有莫尔盐溶液的大试管中滴加浓NaOH溶液,并不断振荡.
生成白色沉淀,迅速变成灰绿色,最终变成红褐色;同时放出大量刺激性且能使红色石蕊试纸变蓝得气体
生成白色沉淀,迅速变成灰绿色,最终变成红褐色;同时放出大量刺激性且能使红色石蕊试纸变蓝得气体
.(2)为了确定产品中亚铁含量,研究小组经查阅资料后,打算用KMnO4(酸化)溶液滴定莫尔盐溶液中的Fe2+.离子方程式为:5Fe2++MnO4-+8H+=5Fe2++Mn2++4H2O.滴定时必须选用的仪器有
①④⑤⑥
①④⑤⑥
(从如图所列仪器中选填编号,同种仪器数量不限);滴定时是否需要加加指示剂?不需要
不需要
.若需要,请指出加什么指示剂;若不需要,请说明理由.Fe2+完全反应,过量的高锰酸钾将使溶液出现紫色,可指示终点
Fe2+完全反应,过量的高锰酸钾将使溶液出现紫色,可指示终点
.
(3)取莫尔盐产品23.520g,配成250mL溶液,取出25.00mL用0.0500mol/LKMnO4溶液滴定,消耗KMnO4溶液19.50mL,则产品中莫尔盐的质量分数
81.3%
81.3%
.不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子的能力越强,在所形成的分子中成为负电荷一方.
下面是某些短周期元素的x值;
(1)通过分析x值变化规律,确定N、Mg的x值范围;
(2)推测x值与原子半径的关系是
(3)某有机化合物结构式为C6H5-S-NH2,其中S-N中,你认为共用电子对偏向谁?
(4)经验规律告诉我们:设成键的两原子相应元素的差值(△x),当△x>1.7时,一般为离子键,当△x<1.7时,一般共价键,试推断AlBr3中化学键类型是
(5)预测元素周期表中,x值最小的元素位置:
查看习题详情和答案>>
下面是某些短周期元素的x值;
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
0.93
0.93
<x(Mg)<1.57
1.57
,2.55
2.55
<x(N)<3.44
3.44
.(2)推测x值与原子半径的关系是
同周期(同主族)中,x值越大,其原子半径越小
同周期(同主族)中,x值越大,其原子半径越小
;根据短周期元素x值变化特点,体现了元素性质的周期性
周期性
变化规律.(3)某有机化合物结构式为C6H5-S-NH2,其中S-N中,你认为共用电子对偏向谁?
氮原子
氮原子
(写原子名称).(4)经验规律告诉我们:设成键的两原子相应元素的差值(△x),当△x>1.7时,一般为离子键,当△x<1.7时,一般共价键,试推断AlBr3中化学键类型是
共价键
共价键
.(5)预测元素周期表中,x值最小的元素位置:
第六周期IA族
第六周期IA族
(放射性元素除外).(2010?杭州一模)食品安全关系国计民生,影响食品安全的因素很多.下面是以食品为主题的相关问题,请根据要求回答.
(1)聚偏二氯乙烯( )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
A.HCl B.Cl2 C.HClO D.NaCl
(2)人们从食用植物油中摄取的亚油酸[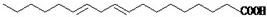 ]对人体健康是十分有益的,然而,市场上经常会出现价格低廉的植物油,其中的亚油酸含量很低.下列关于亚油酸的说法中不正确的是
]对人体健康是十分有益的,然而,市场上经常会出现价格低廉的植物油,其中的亚油酸含量很低.下列关于亚油酸的说法中不正确的是
A.分子式为C18H34O2
B.在食用油中亚油酸通常是以甘油酯的形式存在
C.亚油酸属于一种不饱和低级脂肪酸
D.亚油酸含量高的植物油在空气中易氧化变质
(3)木糖醇[CH2OH(CHOH)3CH2OH]作为一种甜味剂,食用后不会引起血糖升高,比较适合于糖尿病人食用.请预测木糖醇能否和新制备的Cu(OH)2浊液发生化学反应?预测的依据是
(4)酒精在人体肝脏内可转化为多种有害物质,有机物A是其中的一种,对A的结构进行如下分析:
①通过样品的质谱分析测得 A 的相对分子质量为60
②核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值 (信号),根据 峰值 (信号) 可以确定分子中氢原子的种类和数目.例如:乙醇 (CH3CH2OH) 有三种氢原子 (图1).经测定,有机物 A 的核磁共振氢谱示意图如图2
③对 A的水溶液进行测定发现该溶液pH<7
根据以上分析,写出 A 的结构简式
查看习题详情和答案>>
(1)聚偏二氯乙烯(
 )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由CCl2=CH2
CCl2=CH2
(写结构简式)单体发生加聚反应生成的.若以乙炔为原料,通过加成反应生成1,1,2-三氯乙烷,再和氢氧化钠醇溶液反应可合成这种单体,则在上述加成反应中宜选择的加成试剂是AB
AB
.(选填编号字母)A.HCl B.Cl2 C.HClO D.NaCl
(2)人们从食用植物油中摄取的亚油酸[
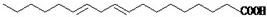 ]对人体健康是十分有益的,然而,市场上经常会出现价格低廉的植物油,其中的亚油酸含量很低.下列关于亚油酸的说法中不正确的是
]对人体健康是十分有益的,然而,市场上经常会出现价格低廉的植物油,其中的亚油酸含量很低.下列关于亚油酸的说法中不正确的是AC
AC
.(选填编号字母)A.分子式为C18H34O2
B.在食用油中亚油酸通常是以甘油酯的形式存在
C.亚油酸属于一种不饱和低级脂肪酸
D.亚油酸含量高的植物油在空气中易氧化变质
(3)木糖醇[CH2OH(CHOH)3CH2OH]作为一种甜味剂,食用后不会引起血糖升高,比较适合于糖尿病人食用.请预测木糖醇能否和新制备的Cu(OH)2浊液发生化学反应?预测的依据是
会反应;因为分子结构中含邻位多羟基结构的物质如甘油、葡萄糖等物质均使Cu(OH)2溶解,溶液呈绛蓝色
会反应;因为分子结构中含邻位多羟基结构的物质如甘油、葡萄糖等物质均使Cu(OH)2溶解,溶液呈绛蓝色
.(4)酒精在人体肝脏内可转化为多种有害物质,有机物A是其中的一种,对A的结构进行如下分析:
①通过样品的质谱分析测得 A 的相对分子质量为60
②核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值 (信号),根据 峰值 (信号) 可以确定分子中氢原子的种类和数目.例如:乙醇 (CH3CH2OH) 有三种氢原子 (图1).经测定,有机物 A 的核磁共振氢谱示意图如图2

③对 A的水溶液进行测定发现该溶液pH<7
根据以上分析,写出 A 的结构简式
CH3COOH
CH3COOH
.合成氨对化学工业和国防工业具有重要意义.
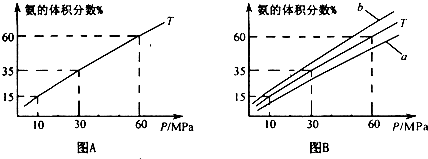
(1)向合成塔中按1:4的物质的量之比充入N2、H2进行氨的合成,图A为T0C时平衡混合物中氨气的体积分数与压强(P)的关系图.
①写出工业上合成氨的化学方程式
②图A中氨气的体积分数为15.00%时,H2的转化率=
③图B中T=500°C,温度为4500C对应的曲线是
④由图象知,增大压强可提高原料的利用率,从生产实际考虑增大压强需解决的问题是
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
CH4(g)+H2O CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
(3)一定温度下,在2L容器中发生上述反应,各物质的物质的量变化如下表
①分析表中数据,判断5?7min之间反应是否处于平衡状态
前5min平均反应速率v(CH4)=
②反应在7~10min之间,CO的物质的量减少的原因可能是
a?减少CH4 b?降低温度c?增大压强d?充入H2
③若保持温度不变,向1L容器中起始充入0.15mol CH4.0.45mol H2O.
查看习题详情和答案>>
(1)向合成塔中按1:4的物质的量之比充入N2、H2进行氨的合成,图A为T0C时平衡混合物中氨气的体积分数与压强(P)的关系图.

①写出工业上合成氨的化学方程式
N2+3H2
2NH3
| ||
| 高温高压 |
N2+3H2
2NH3
.
| ||
| 高温高压 |
②图A中氨气的体积分数为15.00%时,H2的转化率=
24.45%
24.45%
.③图B中T=500°C,温度为4500C对应的曲线是
b
b
(选填字母“a“或“b”),选择的理由是合成氨的正反应是放热反应,根据勒夏特列原理,其他条件不变,降低温度,化学平衡向放热反应方向移动
合成氨的正反应是放热反应,根据勒夏特列原理,其他条件不变,降低温度,化学平衡向放热反应方向移动
④由图象知,增大压强可提高原料的利用率,从生产实际考虑增大压强需解决的问题是
研制耐压设备(或增大压强的动力、材料的强度等其他合理答案)
研制耐压设备(或增大压强的动力、材料的强度等其他合理答案)
(写出一条即可).(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
CH4(g)+H2O
 CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
CO(g)+3H2(g);△H=+QkJ/mol(Q>0)(3)一定温度下,在2L容器中发生上述反应,各物质的物质的量变化如下表
| 时间/min | CH4(mol) | H20( mol) | CO (mol) | H2 (mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | X1 | X2 | X3 | 0.60 |
| 7 | Y1 | Y2 | 0.20 | Y3 |
| 10 | 0.21 | 0.81 | 0.19 | 0.62 |
是
是
(填“是”或“否”),前5min平均反应速率v(CH4)=
0.02mol?min-1
0.02mol?min-1
.②反应在7~10min之间,CO的物质的量减少的原因可能是
d
d
(填字母).a?减少CH4 b?降低温度c?增大压强d?充入H2
③若保持温度不变,向1L容器中起始充入0.15mol CH4.0.45mol H2O.
0.05
0.05
mol CO、0.15
0.15
mol H2,达到平衡时CH4的体积百分含量与第一次投料相同.