题目内容
不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,x越大,其原子吸引电子的能力越强. 下面是某些短周期元素的x值:
(1)通过分析x值变化规律,确定Mg的x值范围:
(2)推测x值与原子半径的关系是
(3)分别指出下列两种化合物中氧元素的化合价:HClO
(4)经验规律告诉我们:当成键的两原子相应元素x数值的差值(△x),当△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键,试推断AlBr3中化学键类型是
(5)预测元素周期表中,x值最小的元素位于
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
0.93
0.93
<x(Mg)<1.57
1.57
.(2)推测x值与原子半径的关系是
同周期(同主族)中,x值大,其原子半径越小
同周期(同主族)中,x值大,其原子半径越小
;根据短周期元素的x值变化特点,体现了元素性质的周期性
周期性
变化规律.(3)分别指出下列两种化合物中氧元素的化合价:HClO
-2
-2
,HFO0
0
.(4)经验规律告诉我们:当成键的两原子相应元素x数值的差值(△x),当△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键,试推断AlBr3中化学键类型是
共价键
共价键
.(5)预测元素周期表中,x值最小的元素位于
第六
第六
周期第IA
第IA
族(放射性元素除外).分析:(1)根据电负性在周期表中的递变规律判断;
(2)根据电负性和原子半径在周期表中的递变规律判断;
(3)根据元素的电负性相对大小确定在化合物中显示的化合价正负,再根据化合物中各元素化合价的代数和为0计算;
(4)根据溴元素和铝元素的电负性差值判断;
(5)根据电负性的递变规律判断.
(2)根据电负性和原子半径在周期表中的递变规律判断;
(3)根据元素的电负性相对大小确定在化合物中显示的化合价正负,再根据化合物中各元素化合价的代数和为0计算;
(4)根据溴元素和铝元素的电负性差值判断;
(5)根据电负性的递变规律判断.
解答:解:(1)同一周期从左到右,元素的电负性逐渐增大,Mg的电负性大于Na的电负性,即大于0.93,同一主族从上到下元素的电负性逐渐减小,则Mg的电负性小于Be的电负性,即小于1.57,故答案为:0.93;1.57;
(2)同一周期周期从左到右,元素的电负性逐渐增大,半径逐渐减小,同一主族从上到下,元素的电负性逐渐减小,原子半径逐渐增大,所以同周期(同主族)中,x值越大,其原子半径越小,体现了元素性质的周期性变化的规律.
故答案为:同周期(同主族)中,x值越大,其原子半径越小;周期性;
( 3 )氯元素的电负性大于氢元素小于氧元素,氧原子和氢原子、氯原子各共用一个电子对,所以氧元素在次氯酸中显示负极,为-2价;
氧元素的电负性大于氢元素小于氟元素,所以在HFO中氢元素显+1价,氟元素显-1价,则O元素为0价,
故答案为:-2;0;
( 4 )AlBr3中,Al元素的电负性为1.61,Br元素的电负性小于3.16,则二者差值小于1.7,AlBr3中化学键类型为共价键,故答案为:共价键;
(5)根据同一周期周期从左到右,元素的电负性逐渐增大,同一主族从上到下,元素的电负性逐渐减小,则电负性最小的元素应位于周期表的左下角,排除放射性元素,应为Cs元素,位于第六周期IA族,故答案为:第六;第IA.
(2)同一周期周期从左到右,元素的电负性逐渐增大,半径逐渐减小,同一主族从上到下,元素的电负性逐渐减小,原子半径逐渐增大,所以同周期(同主族)中,x值越大,其原子半径越小,体现了元素性质的周期性变化的规律.
故答案为:同周期(同主族)中,x值越大,其原子半径越小;周期性;
( 3 )氯元素的电负性大于氢元素小于氧元素,氧原子和氢原子、氯原子各共用一个电子对,所以氧元素在次氯酸中显示负极,为-2价;
氧元素的电负性大于氢元素小于氟元素,所以在HFO中氢元素显+1价,氟元素显-1价,则O元素为0价,
故答案为:-2;0;
( 4 )AlBr3中,Al元素的电负性为1.61,Br元素的电负性小于3.16,则二者差值小于1.7,AlBr3中化学键类型为共价键,故答案为:共价键;
(5)根据同一周期周期从左到右,元素的电负性逐渐增大,同一主族从上到下,元素的电负性逐渐减小,则电负性最小的元素应位于周期表的左下角,排除放射性元素,应为Cs元素,位于第六周期IA族,故答案为:第六;第IA.
点评:本题考查电负性的递变规律,题目难度中等,注意元素周期律的主要内容,理解电负性的意义和应用.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目

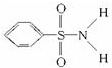 ,其中S-N中,你认为共用电子对偏向
,其中S-N中,你认为共用电子对偏向