摘要:2.原理.规律.疑难剖析:
网址:http://m.1010jiajiao.com/timu3_id_51283[举报]
下列根据有关原理或规律得出的推断合理的是( )
| A、根据酸性氧化物的性质,推知有反应:SiO2+H2O=H2SiO3 | ||
B、根据强电解质的电离原理,推知1mol?L-1NaHSO4溶液中HSO
| ||
| C、根据盖斯定律,推知在相冋条件下,红磷或白磷燃烧生成1molP2O5回体时,放出的热量相等 | ||
| D、根据同主族物质性质的相似性和递变性,推知CsOH属于强碱 |
下列根据有关原理或规律得出的推断合理的是
[ ]
A. 根据酸性氧化物的性质,推知有反应: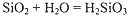
B. 根据强电解质的电离原理,推知 溶液中
溶液中 浓度为
浓度为
C. 根据盖斯定律,推知在相冋条件下,红磷或A磷燃烧生成1molP2O5回体时,放出的热量相等
D. 根据同主族物质性质的相似性和递变性,推知CsOH属于强碱
查看习题详情和答案>>
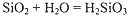
B. 根据强电解质的电离原理,推知
 溶液中
溶液中 浓度为
浓度为
C. 根据盖斯定律,推知在相冋条件下,红磷或A磷燃烧生成1molP2O5回体时,放出的热量相等
D. 根据同主族物质性质的相似性和递变性,推知CsOH属于强碱
甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素.其设计的实验方案如下,请你帮他填写完整,并做出评价.
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
【评价】甲同学设计的实验方案的合理性是
A.非常合理B.部分合理C.完全不合理
【补充和完善】上一项若填A,则此项不用再作答,若填B或C,则完成实验还需要的试剂是
(2)探究影响化学反应速率的因素
甲同学所得实验依据和结论有明显问题,问题是
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性.画出实验装置图,标出正负极、电子流动方向,写出电极反应式.
装置图

电极反应式
查看习题详情和答案>>
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
| 实验步骤 | 实验现象 | 实验结论及离子方程式 |
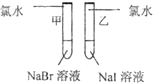 |
甲 溶液由无色变为橙色 溶液由无色变为橙色 乙 溶液由无色变为黄色 溶液由无色变为黄色 |
离子方程式 甲: 2Br-+Cl2═Br2+2Cl- 2Br-+Cl2═Br2+2Cl- 乙: 2I-+Cl2═2Cl-+I2 2I-+Cl2═2Cl-+I2 结论:卤素单质的氧化强到弱的顺序为Cl2>Br2>I2 |
B
B
(填序号)A.非常合理B.部分合理C.完全不合理
【补充和完善】上一项若填A,则此项不用再作答,若填B或C,则完成实验还需要的试剂是
溴水
溴水
.(2)探究影响化学反应速率的因素
| 实验步骤 | 实验现象 | 实验依据和结论 |
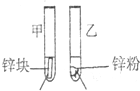 3mL1mol/L 3mL3mol/L 盐酸 盐酸 (金属质量相同,盐酸均过量) |
均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快. |
锌粉的表面积大,也能加快反应速率
锌粉的表面积大,也能加快反应速率
.(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性.画出实验装置图,标出正负极、电子流动方向,写出电极反应式.
装置图

电极反应式
负极:Fe-2e-═Fe2+
负极:Fe-2e-═Fe2+
正极:2H++2e-═H2↑
正极:2H++2e-═H2↑
.液氯储罐中常混有NCl3,当液氯中NCl3的质量分数达到4%以上就有爆炸危险.
(1)NCl3易水解生成一种碱性气体和一种具有漂白性的物质.写出该反应的化学方程式 .
(2)为测定氯气中的NCl3含量,将一定量样品先通过足量盐酸吸收NCl3(反应为:NCl3+4HCl→NH4Cl+3Cl2),再用400mL 20.0%(ρ=1.22g/cm3)的工业NaOH溶液吸收所有的Cl2,测得吸收后NaOH溶液增重51.4g.经测定NCl3吸收管内NH4+质量为0.270g.
①上述工业NaOH溶液的物质的量浓度为 .
②计算该样品中NCl3的质量分数,并判断该样品是否安全?
(3)一般情况下,较强的氧化剂如:MnO2、KMnO4、KClO3、Ca(ClO)2等氧化浓盐酸时,有如下反应规律:氧化剂+浓盐酸→金属氯化物+水+氯气.实验室通常用该原理制取少量Cl2.
①将214.5g Ca(ClO)2放入500mL 12.0mol/L的浓盐酸中,生成的Cl2在标准状况下的体积为39.2L.若反应前后溶液的体积保持不变,计算反应后溶液中HCl的物质的量浓度.
②漂白粉是 Ca(ClO)2、CaCl2、Ca(OH)2、H2O和CaO的混合物.漂白粉放出的氯气具有漂白作用,叫有效氯.通常用有效氯表示漂白粉的纯度.漂白粉中的有效氯含量常用滴定碘法进行测定,即在一定量的漂白粉中加入过量的KI,加H2SO4酸化,有效氯与I-作用析出等量的I2,析出的I2以淀粉指示剂立即用Na2S2O3标准溶液滴定.若测定漂白粉中有效氯时用盐酸酸化,则盐酸的浓度应小于 mol/L,否则测定的有效氯将 (选填“偏高”、“偏低”或“不变”).
查看习题详情和答案>>
(1)NCl3易水解生成一种碱性气体和一种具有漂白性的物质.写出该反应的化学方程式
(2)为测定氯气中的NCl3含量,将一定量样品先通过足量盐酸吸收NCl3(反应为:NCl3+4HCl→NH4Cl+3Cl2),再用400mL 20.0%(ρ=1.22g/cm3)的工业NaOH溶液吸收所有的Cl2,测得吸收后NaOH溶液增重51.4g.经测定NCl3吸收管内NH4+质量为0.270g.
①上述工业NaOH溶液的物质的量浓度为
②计算该样品中NCl3的质量分数,并判断该样品是否安全?
(3)一般情况下,较强的氧化剂如:MnO2、KMnO4、KClO3、Ca(ClO)2等氧化浓盐酸时,有如下反应规律:氧化剂+浓盐酸→金属氯化物+水+氯气.实验室通常用该原理制取少量Cl2.
①将214.5g Ca(ClO)2放入500mL 12.0mol/L的浓盐酸中,生成的Cl2在标准状况下的体积为39.2L.若反应前后溶液的体积保持不变,计算反应后溶液中HCl的物质的量浓度.
②漂白粉是 Ca(ClO)2、CaCl2、Ca(OH)2、H2O和CaO的混合物.漂白粉放出的氯气具有漂白作用,叫有效氯.通常用有效氯表示漂白粉的纯度.漂白粉中的有效氯含量常用滴定碘法进行测定,即在一定量的漂白粉中加入过量的KI,加H2SO4酸化,有效氯与I-作用析出等量的I2,析出的I2以淀粉指示剂立即用Na2S2O3标准溶液滴定.若测定漂白粉中有效氯时用盐酸酸化,则盐酸的浓度应小于
(1)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO  2CO2+N2
2CO2+N2
研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中:
①请在表格中填入剩余的实验条件数据.
②设计实验Ⅱ、Ⅲ的目的是
(2)工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3与NOx反应生成无毒的物质.某同学采用以下装置和步骤模拟工业上氮的氧化物处理过程.提供的装置:
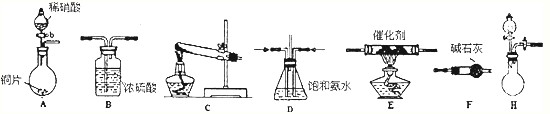
步骤一、NH3的制取
①所提供的装置中能快速、简便制取NH3的装置是:
②若采用C装置制取氨气(控制实验条件相同),情况如下表:
分析表中数据,实验室制NH3产率最高的是
步骤二、模拟尾气的处理:
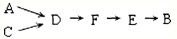
选用上述部分装置,按下列顺序连接成模拟尾气处理装置:
③A中反应的离子方程式:
④D装置作用有:使气体混合均匀、调节气流速度,还有一个作用是:
⑤D装置中的液体可换成
a.CuSO4溶液 b.H2O c.CCl4 d.浓H2SO4
⑥该同学所设计的模拟尾气处理实验还存在的明显缺陷是:
查看习题详情和答案>>
 2CO2+N2
2CO2+N2研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中:
| 实验编号 | T/℃ | NO初始浓度 mol?L-1 |
CO初始浓度 mol?L-1Com] |
催化剂的比表面积 ㎡?g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
②设计实验Ⅱ、Ⅲ的目的是
探究温度对化学反应速率的影响
探究温度对化学反应速率的影响
.(2)工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3与NOx反应生成无毒的物质.某同学采用以下装置和步骤模拟工业上氮的氧化物处理过程.提供的装置:

步骤一、NH3的制取
①所提供的装置中能快速、简便制取NH3的装置是:
H
H
(填装置序号).②若采用C装置制取氨气(控制实验条件相同),情况如下表:
| 试剂组合序号 | 固体试剂(g) | NH3体积(ml) | |
| a | 12.0gCa(OH)2(过量) | 10.8gNH4Cl | 2688 |
| b | 10.8g(NH4)2SO4 | 2728 | |
| c | 12.0gNaOH(过量) | 10.8gNH4Cl | 3136 |
| d | 10.8g(NH4)2SO4 | 3118 | |
| e | 12.0gCaO(过量) | 10.8gNH4Cl | 3506 |
| f | 10.8g(NH4)2SO4 | 3584 | |
f
f
(填序号).步骤二、模拟尾气的处理:
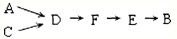
选用上述部分装置,按下列顺序连接成模拟尾气处理装置:
③A中反应的离子方程式:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.④D装置作用有:使气体混合均匀、调节气流速度,还有一个作用是:
防止氨气溶解(或防止倒吸)
防止氨气溶解(或防止倒吸)
.⑤D装置中的液体可换成
C
C
(填序号).a.CuSO4溶液 b.H2O c.CCl4 d.浓H2SO4
⑥该同学所设计的模拟尾气处理实验还存在的明显缺陷是:
未反应的NO无法处理,会污染环境
未反应的NO无法处理,会污染环境
.