题目内容
下列根据有关原理或规律得出的推断合理的是( )
| A、根据酸性氧化物的性质,推知有反应:SiO2+H2O=H2SiO3 | ||
B、根据强电解质的电离原理,推知1mol?L-1NaHSO4溶液中HSO
| ||
| C、根据盖斯定律,推知在相冋条件下,红磷或白磷燃烧生成1molP2O5回体时,放出的热量相等 | ||
| D、根据同主族物质性质的相似性和递变性,推知CsOH属于强碱 |
分析:A、二氧化硅不溶于水;
B、硫酸氢钠在溶液中的电离方程式为:NaHSO4=Na++H++SO42-;
C、白磷和红磷所具有的能量不同;
D、根据元素周期律考虑.
B、硫酸氢钠在溶液中的电离方程式为:NaHSO4=Na++H++SO42-;
C、白磷和红磷所具有的能量不同;
D、根据元素周期律考虑.
解答:解:A、由于二氧化硅不溶于水,所以二氧化硅不和水反应,故A错误;
B、硫酸氢钠在溶液中的电离方程式为:NaHSO4=Na++H++SO42-,所以NaHSO4溶液中无HSO4-,故B错误;
C、根据盖斯定律,反应热只与起始状态有关,与反应途径无关,由于白磷和红磷具有能量不同,所以燃烧生成1molP2O5回体时,放出的热量不相等,故C错误;
D、根据元素周期律,同族元素最高价氧化物对应水化物的碱性从上到下依次增强,由于氢氧化钠为强碱,所以氢氧化铯碱性比氢氧化钠强,故D正确.
故选D.
B、硫酸氢钠在溶液中的电离方程式为:NaHSO4=Na++H++SO42-,所以NaHSO4溶液中无HSO4-,故B错误;
C、根据盖斯定律,反应热只与起始状态有关,与反应途径无关,由于白磷和红磷具有能量不同,所以燃烧生成1molP2O5回体时,放出的热量不相等,故C错误;
D、根据元素周期律,同族元素最高价氧化物对应水化物的碱性从上到下依次增强,由于氢氧化钠为强碱,所以氢氧化铯碱性比氢氧化钠强,故D正确.
故选D.
点评:本题考查了化学反应原理.特别注意硫酸氢盐在溶液中会完全电离出氢离子,而弱酸的酸式盐不会完全电离出氢离子.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案
相关题目
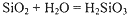
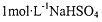 溶液中
溶液中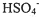 浓度为
浓度为