网址:http://m.1010jiajiao.com/timu3_id_49514[举报]
(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、
(2)为什么中和热测定中要用稍过量的碱(或酸):
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4 18J/(g?℃).为了计算中和热,某学生实验记录数据如下:

依据该学生的实验数据计算,该实验测得的中和热△H=
(4)上述实验数值结果与中和热的理论值57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)
a.实验装置保温、隔热效果差 b.量取盐酸与氢氧化钠溶液时仰视读数c.分多次把Na0H溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度.
分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ;
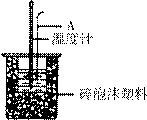 (2)如右图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H (填“偏大”、“偏小”或“无影响”);
(2)如右图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H (填“偏大”、“偏小”或“无影响”);
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g?℃)。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1℃ | 终止温度t2℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=________________;(结果保留一位小数)
(4) (填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是 。
查看习题详情和答案>>分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、 、 。
(2)为什么中和热测定中要用稍过量的碱(或酸):
(3) 假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:
| 实验序号 | 起始温度t1℃ | 最高温度t2℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.1 | 20.1 | 23.2 |
| 2 | 20.2 | 20.2 | 23.1 |
| 3 | 20.5 | 20.5 | 25.3 |
依据该学生的实验数据计算,该实验测得的中和热△H=______;(结果保留一位小数)
(4)上述实验数值结果与中和热的理论值57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差 b.量取盐酸与氢氧化钠溶液时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度
查看习题详情和答案>>(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、______、______.
(2)为什么中和热测定中要用稍过量的碱(或酸):______
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4 18J/.为了计算中和热,某学生实验记录数据如下:

依据该学生的实验数据计算,该实验测得的中和热△H=______; (结果保留一位小数)
(4)上述实验数值结果与中和热的理论值57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)______.
a.实验装置保温、隔热效果差 b.量取盐酸与氢氧化钠溶液时仰视读数c.分多次把Na0H溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度.
查看习题详情和答案>>
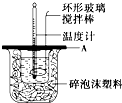 分别取40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
分别取40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.(1)理论上稀强酸、稀强碱反应生成1mol 水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式
(2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其原因是
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g?℃).为了计算中和热,实验时还需测量的数据有(填序号)
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度
D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
| 实验 序号 |
起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |