摘要:硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂.广泛用于水的处理.用铁的氧化物为原料来制取聚合硫酸猴.为控制水解时Fe3+的浓度.防止生成氢氧化铁沉淀.原料中的Fe3+必须先还原为Fe2+.实验步骤如下: (1)用98%的硫酸配制28%的硫酸.所需的玻璃仪器除量筒外.还有 . 烧杯 (c) 烧瓶 (2)步骤II取样分析溶液中的Fe2+.Fe3+的含量.目的是 . (a) 控制溶液中Fe2+与Fe3+含量比 (b) 确定下一步还原所需铁的量 (c) 确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全 (3)用NaClO3氧化时反应方程式如下: 6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O 若改用HNO3氧化.则反应方程式如下 6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + NO↑ + 4H2O 已知1mol HNO3价格0.16元.1mol NaClO3价格0.45元.评价用HNO3代替NaClO3作氧化剂的得弊.利是 .弊是 . 聚合硫酸铁溶液中SO42¯与Fe3+物质的量之比不是3:2.根据下列供选择的试剂和基本操作.测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比. (4)测定时所需的试剂 . FeSO4 (c) BaCl2 (d) NaClO3 (5)需要测定 和 的质量. (6)选出测定过程中所需的基本操作 . 过滤.洗涤 (c) 蒸发.结晶 烘干或灼烧
网址:http://m.1010jiajiao.com/timu3_id_46891[举报]
聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.现用一定质量的铁的氧化物(如下图)为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+.实验步骤如下:
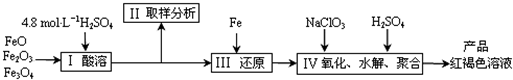
(1)实验室用18.4mol?L-1的浓硫酸配制250mL4.8mol?L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种带有刻度的移液管)外,还需
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是
A.控制溶液中Fe2+与Fe3+含量比 B.确定下一步还原所需铁的量
C.确定氧化Fe2+所需NaClO3的量 D.确保铁的氧化物酸溶完全
(3)写出步骤Ⅳ中用NaClO3氧化时的离子方程式
已知1mol HNO3的价格为0.16元,1mol NaClO3的价格为0.45元,评价用HNO3代替NaClO3作为氧化剂的利弊,利是
(4)为了分析产品聚合硫酸铁溶液中SO42-与Fe3+物质的量之比,有人设计了以下操作:
(a)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤、洗涤、干燥后,称重,其质量为m g.
(b)另取25mL聚合硫酸铁溶液,加足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL,用KMnO4酸性溶液滴定,到达终点时用去0.1000mol/L KMnO4标准溶液VmL.反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
回答下列问题:
①判断(a)步骤溶液中SO42-离子已沉淀完全的方法是
②在(b)步骤中判断达到终点的现象是
③聚合硫酸铁中SO42-与Fe3+的物质的量之比为
=
=
(用含m、V的代数式表示).
查看习题详情和答案>>

(1)实验室用18.4mol?L-1的浓硫酸配制250mL4.8mol?L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种带有刻度的移液管)外,还需
250mL容量瓶、胶头滴管
250mL容量瓶、胶头滴管
.(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是
BC
BC
.A.控制溶液中Fe2+与Fe3+含量比 B.确定下一步还原所需铁的量
C.确定氧化Fe2+所需NaClO3的量 D.确保铁的氧化物酸溶完全
(3)写出步骤Ⅳ中用NaClO3氧化时的离子方程式
6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
(提示:ClO3-转化为Cl-);已知1mol HNO3的价格为0.16元,1mol NaClO3的价格为0.45元,评价用HNO3代替NaClO3作为氧化剂的利弊,利是
原料成本较低
原料成本较低
,弊是产生气体对大气有污染
产生气体对大气有污染
.(4)为了分析产品聚合硫酸铁溶液中SO42-与Fe3+物质的量之比,有人设计了以下操作:
(a)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤、洗涤、干燥后,称重,其质量为m g.
(b)另取25mL聚合硫酸铁溶液,加足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL,用KMnO4酸性溶液滴定,到达终点时用去0.1000mol/L KMnO4标准溶液VmL.反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
回答下列问题:
①判断(a)步骤溶液中SO42-离子已沉淀完全的方法是
取上层清夜,滴加BaCl2溶液,若无沉淀产生,则溶液中SO42-已沉淀完全
取上层清夜,滴加BaCl2溶液,若无沉淀产生,则溶液中SO42-已沉淀完全
;②在(b)步骤中判断达到终点的现象是
溶液由浅蓝色变为浅紫红色,且半分钟内不变色
溶液由浅蓝色变为浅紫红色,且半分钟内不变色
;③聚合硫酸铁中SO42-与Fe3+的物质的量之比为
| m |
| 233 |
| V |
| 200 |
| m |
| 233 |
| V |
| 200 |
(2010?江苏二模)硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,现用铁的氧化物为原料来制取聚合硫酸铁的过程如下:
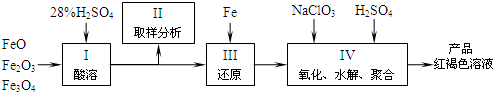
(1)用98%的硫酸配制28%的稀硫酸,所需的玻璃仪器除量筒外,还有
A.玻璃棒 B.烧杯 C.烧瓶 D.容量瓶
(2)配平以下离子方程式:
(3)聚合硫酸铁溶液中SO42-与Fe3+物质的量之比不是3:2.为了测定聚合硫酸铁中SO42-与Fe3+物质的量之比,应选择的试剂是
A.NaOH B.FeSO4 C.BaCl2 D.NaClO3
实验时需要测定的量是Fe2O3和
查看习题详情和答案>>

(1)用98%的硫酸配制28%的稀硫酸,所需的玻璃仪器除量筒外,还有
AB
AB
.A.玻璃棒 B.烧杯 C.烧瓶 D.容量瓶
(2)配平以下离子方程式:
6
6
Fe2++1
1
ClO3-+6
6
H+=6
6
Fe3++1
1
Cl-+3H2O
3H2O
(3)聚合硫酸铁溶液中SO42-与Fe3+物质的量之比不是3:2.为了测定聚合硫酸铁中SO42-与Fe3+物质的量之比,应选择的试剂是
AC
AC
(填序号).A.NaOH B.FeSO4 C.BaCl2 D.NaClO3
实验时需要测定的量是Fe2O3和
BaSO4
BaSO4
的质量(填写化合物的化学式).聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+.实验步骤如下:

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有
(a)玻璃棒 (b)烧杯 (c)烧瓶
(2)步骤II取样分析溶液中Fe2+、Fe3+的含量,目的是
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确保铁的氧化物酸溶完全 (c) 确定下一步还原所需铁的量
(3)完成步骤IV中的氧化还原反应:补充产物并配平:
(4)聚合硫酸铁溶液中SO42?与Fe3+物质的量之比不是3:2.根据下列提供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42?与Fe3+物质的量之比.测定时所需的试剂
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
需要测定Fe2O3和
查看习题详情和答案>>

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有
ab
ab
.(a)玻璃棒 (b)烧杯 (c)烧瓶
(2)步骤II取样分析溶液中Fe2+、Fe3+的含量,目的是
C
C
和确定氧化Fe2+所需NaClO3的量:(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确保铁的氧化物酸溶完全 (c) 确定下一步还原所需铁的量
(3)完成步骤IV中的氧化还原反应:补充产物并配平:
6
6
Fe2++1
1
ClO3-+6
6
H+=6
6
Fe3++Cl-+3H2O
3H2O
(4)聚合硫酸铁溶液中SO42?与Fe3+物质的量之比不是3:2.根据下列提供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42?与Fe3+物质的量之比.测定时所需的试剂
ac
ac
.(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
需要测定Fe2O3和
BaSO4
BaSO4
的质量(填写化合物的化学式).聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原成Fe2+.实验步骤如下:
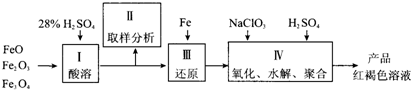
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 .
A.容量瓶;B.烧杯;C.烧瓶
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是 .
A.控制溶液中Fe2+与Fe3+含量比; B.确定下一步还原所需铁的量
C.确定氧化Fe2+所需NaClO3的量; D.确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4+NaClO3+3H2SO4→3Fe2(SO4)3+NaCl+3H2O
若改用硝酸氧化,则反应方程式如下:
6FeSO4+2HNO3+3H2SO4→3Fe2(SO4)3+2NO↑+4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊.利是 ,弊是 .
聚合硫酸铁溶液中SO42-与Fe3+物质的量之比不是3:2.根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42-与Fe3+物质的量之比.
(4)测定时所需的试剂 .
A.NaOH; B.FeSO4 ;C.BaCl2 ;D.NaClO3
(5)需要测定 和 的质量(填写化合物的化学式).
(6)选出测定过程中所需的基本操作 (按操作先后顺序列出).
A.萃取、分液 B.过滤、洗涤
C.蒸发、结品 D.冷却、称量 E.烘干或灼烧.
查看习题详情和答案>>

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有
A.容量瓶;B.烧杯;C.烧瓶
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是
A.控制溶液中Fe2+与Fe3+含量比; B.确定下一步还原所需铁的量
C.确定氧化Fe2+所需NaClO3的量; D.确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4+NaClO3+3H2SO4→3Fe2(SO4)3+NaCl+3H2O
若改用硝酸氧化,则反应方程式如下:
6FeSO4+2HNO3+3H2SO4→3Fe2(SO4)3+2NO↑+4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊.利是
聚合硫酸铁溶液中SO42-与Fe3+物质的量之比不是3:2.根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42-与Fe3+物质的量之比.
(4)测定时所需的试剂
A.NaOH; B.FeSO4 ;C.BaCl2 ;D.NaClO3
(5)需要测定
(6)选出测定过程中所需的基本操作
A.萃取、分液 B.过滤、洗涤
C.蒸发、结品 D.冷却、称量 E.烘干或灼烧.
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(0H)n(S04)3-n/2]m是一种新型高效的水 处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设 计如下方案制备上述两种产品:

请回答下列问题:
(1)若A为H20(g),可以得到Fe304,写出H2O的电子式:_______.
(2)若B为NaC103与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-): ____。
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸鉀的化学方程式 并配平:

(4)为测定溶液I中铁元素的总含量,实验操作:准确量取20.00mL溶液I于带塞锥形瓶 中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol.L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:
①写出滴定选用的指示剂______,滴定终点观察到的现象______:
②溶液丨中轶元素的总含量为______g.L-1。若滴定前溶液中H202没有除尽,所测定的铁元 素的含量将会______ (填“偏高” “偏低” “不变”)。
(5)设计实验方案,检验溶液I中的Fe2+和Fe3+ ______。
查看习题详情和答案>>