��Ŀ����
�ۺ���������PFS����һ������Ч�����߷������������㷺����ˮ�Ĵ���������һ���������������������ͼ��Ϊԭ������ȡ�ۺ���������Ϊ����ˮ��ʱFe3+��Ũ�ȣ���ֹ������������������ԭ���е�Fe3+�����Ȼ�ԭΪFe2+��ʵ�鲽�����£�
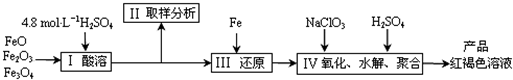
��1��ʵ������18.4mol?L-1��Ũ��������250mL4.8mol?L-1��������Һ�����õIJ����������ձ����������������ܣ�һ�ִ��п̶ȵ���Һ�ܣ��⣬����
��2�������ȡ��������Һ�е�Fe2+��Fe3+�ĺ�����Ŀ����
A��������Һ��Fe2+��Fe3+������ B��ȷ����һ����ԭ����������
C��ȷ������Fe2+����NaClO3���� D��ȷ������������������ȫ
��3��д�����������NaClO3����ʱ�����ӷ���ʽ
��֪1mol HNO3�ļ۸�Ϊ0.16Ԫ��1mol NaClO3�ļ۸�Ϊ0.45Ԫ��������HNO3����NaClO3��Ϊ�����������ף�����
��4��Ϊ�˷�����Ʒ�ۺ���������Һ��SO42-��Fe3+���ʵ���֮�ȣ�������������²�����
��a��ȡ25mL�ۺ���������Һ������������BaCl2��Һ��������ɫ��������ɫ�����������ˡ�ϴ�ӡ�������أ�������Ϊm g��
��b����ȡ25mL�ۺ���������Һ��������ͭ�ۣ���ַ�Ӧ����ˡ�ϴ�ӣ�����Һ��ϴҺ�ϲ����250mL��Һ��ȡ����Һ25.00mL����KMnO4������Һ�ζ��������յ�ʱ��ȥ0.1000mol/L KMnO4����ҺVmL����Ӧ�����ӷ���ʽΪ��5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
�ش��������⣺
���жϣ�a��������Һ��SO42-�����ѳ�����ȫ�ķ�����
���ڣ�b���������жϴﵽ�յ��������
�۾ۺ���������SO42-��Fe3+�����ʵ���֮��Ϊ
=
=
���ú�m��V�Ĵ���ʽ��ʾ����

��1��ʵ������18.4mol?L-1��Ũ��������250mL4.8mol?L-1��������Һ�����õIJ����������ձ����������������ܣ�һ�ִ��п̶ȵ���Һ�ܣ��⣬����
250mL����ƿ����ͷ�ι�
250mL����ƿ����ͷ�ι�
����2�������ȡ��������Һ�е�Fe2+��Fe3+�ĺ�����Ŀ����
BC
BC
��A��������Һ��Fe2+��Fe3+������ B��ȷ����һ����ԭ����������
C��ȷ������Fe2+����NaClO3���� D��ȷ������������������ȫ
��3��д�����������NaClO3����ʱ�����ӷ���ʽ
6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
����ʾ��ClO3-ת��ΪCl-������֪1mol HNO3�ļ۸�Ϊ0.16Ԫ��1mol NaClO3�ļ۸�Ϊ0.45Ԫ��������HNO3����NaClO3��Ϊ�����������ף�����
ԭ�ϳɱ��ϵ�
ԭ�ϳɱ��ϵ�
��������������Դ�������Ⱦ
��������Դ�������Ⱦ
����4��Ϊ�˷�����Ʒ�ۺ���������Һ��SO42-��Fe3+���ʵ���֮�ȣ�������������²�����
��a��ȡ25mL�ۺ���������Һ������������BaCl2��Һ��������ɫ��������ɫ�����������ˡ�ϴ�ӡ�������أ�������Ϊm g��
��b����ȡ25mL�ۺ���������Һ��������ͭ�ۣ���ַ�Ӧ����ˡ�ϴ�ӣ�����Һ��ϴҺ�ϲ����250mL��Һ��ȡ����Һ25.00mL����KMnO4������Һ�ζ��������յ�ʱ��ȥ0.1000mol/L KMnO4����ҺVmL����Ӧ�����ӷ���ʽΪ��5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
�ش��������⣺
���жϣ�a��������Һ��SO42-�����ѳ�����ȫ�ķ�����
ȡ�ϲ���ҹ���μ�BaCl2��Һ������������������Һ��SO42-�ѳ�����ȫ
ȡ�ϲ���ҹ���μ�BaCl2��Һ������������������Һ��SO42-�ѳ�����ȫ
�����ڣ�b���������жϴﵽ�յ��������
��Һ��dz��ɫ��Ϊdz�Ϻ�ɫ���Ұ�����ڲ���ɫ
��Һ��dz��ɫ��Ϊdz�Ϻ�ɫ���Ұ�����ڲ���ɫ
���۾ۺ���������SO42-��Fe3+�����ʵ���֮��Ϊ
| m |
| 233 |
| V |
| 200 |
| m |
| 233 |
| V |
| 200 |
��������1����������һ����������Һ�IJ��裺���㡢�������ܽ⣬ȷ�����õ�������
��2��Ϊ����ˮ��ʱFe3+��Ũ�ȣ���ֹ������������������ԭ���е�Fe3+�����Ȼ�ԭΪFe2+��Ȼ��Fe2+�ٱ�����Fe3+��
��3������������ԭ��Ӧ�л��ϼ���������Լ�����غ㡢�����غ�����𣬴ӻ����ͳɱ����濼�ǣ�
��4�����ж�SO42-�����ѳ�����ȫ�ķ�����ȡ�ϲ���ҹ���μ�BaCl2��Һ������������������Һ��SO42-�ѳ�����ȫ��
�ڴﵽ�յ�ʱ������ع�������Һ��dz��ɫ��Ϊdz�Ϻ�ɫ���Ұ�����ڲ���ɫ��
�۷ֱ�����ۺ���������SO42-��Fe3+�����ʵ������ú�m��V�Ĵ���ʽ��ʾ����
��2��Ϊ����ˮ��ʱFe3+��Ũ�ȣ���ֹ������������������ԭ���е�Fe3+�����Ȼ�ԭΪFe2+��Ȼ��Fe2+�ٱ�����Fe3+��
��3������������ԭ��Ӧ�л��ϼ���������Լ�����غ㡢�����غ�����𣬴ӻ����ͳɱ����濼�ǣ�
��4�����ж�SO42-�����ѳ�����ȫ�ķ�����ȡ�ϲ���ҹ���μ�BaCl2��Һ������������������Һ��SO42-�ѳ�����ȫ��
�ڴﵽ�յ�ʱ������ع�������Һ��dz��ɫ��Ϊdz�Ϻ�ɫ���Ұ�����ڲ���ɫ��
�۷ֱ�����ۺ���������SO42-��Fe3+�����ʵ������ú�m��V�Ĵ���ʽ��ʾ����
����⣺��1������һ��������������Һ��Ҫ�������У���ͷ�ιܡ���Ͳ�����������ձ���
�ʴ�Ϊ��250mL����ƿ����ͷ�ιܣ�
��2����Ϊ����ˮ��ʱFe3+��Ũ�ȣ���ֹ������������������ԭ���е�Fe3+�����Ȼ�ԭΪFe2+������ȷ����һ����ԭ������������Ȼ��Fe2+�ٱ�����Fe3+����Ҫȷ������Fe2+����NaClO3������
�ʴ�Ϊ��BC��
��3��Fe2+��+2�����ߵ�+3�ۣ�ClO3-��Cl�Ļ��ϼ۴�+5�۽��͵�-1�ۣ���6Fe2++ClO3-+H+--6Fe3++Cl-���ɵ���غ㡢�����غ�ã�6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O���ӻ����ͳɱ����濼������ԭ�ϳɱ��ϵͣ����Dz�������Դ�������Ⱦ��
�ʴ�Ϊ��6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O�� ԭ�ϳɱ��ϵͣ���������Դ�������Ⱦ��
��4�������ж�SO42-�����ѳ�����ȫ�ķ�����ȡ�ϲ���ҹ���μ�BaCl2��Һ������������������Һ��SO42-�ѳ�����ȫ��
�ʴ�Ϊ��ȡ�ϲ���ҹ���μ�BaCl2��Һ������������������Һ��SO42-�ѳ�����ȫ��
�ڴﵽ�յ�ʱ������ع�������Һ��dz��ɫ��Ϊdz�Ϻ�ɫ���Ұ�����ڲ���ɫ��
�ʴ�Ϊ����Һ��dz��ɫ��Ϊdz�Ϻ�ɫ���Ұ�����ڲ���ɫ
��25mL��Һ�к��ۺ���������SO42-�����ʵ���Ϊ��
mol��
��Fe3+�����ʵ���Ϊx��
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
1 5
0.1mol/L��0.001VL
���x=
mol��
�ʴ�Ϊ��
=
�ʴ�Ϊ��250mL����ƿ����ͷ�ιܣ�
��2����Ϊ����ˮ��ʱFe3+��Ũ�ȣ���ֹ������������������ԭ���е�Fe3+�����Ȼ�ԭΪFe2+������ȷ����һ����ԭ������������Ȼ��Fe2+�ٱ�����Fe3+����Ҫȷ������Fe2+����NaClO3������
�ʴ�Ϊ��BC��
��3��Fe2+��+2�����ߵ�+3�ۣ�ClO3-��Cl�Ļ��ϼ۴�+5�۽��͵�-1�ۣ���6Fe2++ClO3-+H+--6Fe3++Cl-���ɵ���غ㡢�����غ�ã�6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O���ӻ����ͳɱ����濼������ԭ�ϳɱ��ϵͣ����Dz�������Դ�������Ⱦ��
�ʴ�Ϊ��6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O�� ԭ�ϳɱ��ϵͣ���������Դ�������Ⱦ��
��4�������ж�SO42-�����ѳ�����ȫ�ķ�����ȡ�ϲ���ҹ���μ�BaCl2��Һ������������������Һ��SO42-�ѳ�����ȫ��
�ʴ�Ϊ��ȡ�ϲ���ҹ���μ�BaCl2��Һ������������������Һ��SO42-�ѳ�����ȫ��
�ڴﵽ�յ�ʱ������ع�������Һ��dz��ɫ��Ϊdz�Ϻ�ɫ���Ұ�����ڲ���ɫ��
�ʴ�Ϊ����Һ��dz��ɫ��Ϊdz�Ϻ�ɫ���Ұ�����ڲ���ɫ
��25mL��Һ�к��ۺ���������SO42-�����ʵ���Ϊ��
| m |
| 233 |
��Fe3+�����ʵ���Ϊx��
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
1 5
0.1mol/L��0.001VL
| x |
| 10 |
���x=
| V |
| 200 |
�ʴ�Ϊ��
| m |
| 233 |
| V |
| 200 |
�����������������仯����Ϊ���壬������ͼ��ʽ������������ԭ��Ӧ֪ʶ��Ԫ�ػ������֪ʶ��

��ϰ��ϵ�д�
�����Ŀ

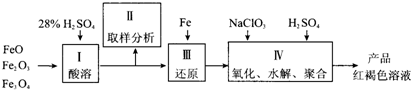
 Ҫ����;��
Ҫ����;�� ���������ؽ������ӡ���PFS������ԭ��δ�ɶԵ�����Ϊ__ ����
���������ؽ������ӡ���PFS������ԭ��δ�ɶԵ�����Ϊ__ ���� ____ ��
____ ��