题目内容
聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原成Fe2+.实验步骤如下:
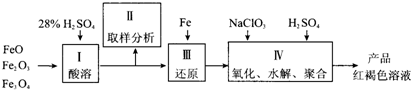
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 .
A.容量瓶;B.烧杯;C.烧瓶
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是 .
A.控制溶液中Fe2+与Fe3+含量比; B.确定下一步还原所需铁的量
C.确定氧化Fe2+所需NaClO3的量; D.确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4+NaClO3+3H2SO4→3Fe2(SO4)3+NaCl+3H2O
若改用硝酸氧化,则反应方程式如下:
6FeSO4+2HNO3+3H2SO4→3Fe2(SO4)3+2NO↑+4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊.利是 ,弊是 .
聚合硫酸铁溶液中SO42-与Fe3+物质的量之比不是3:2.根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42-与Fe3+物质的量之比.
(4)测定时所需的试剂 .
A.NaOH; B.FeSO4 ;C.BaCl2 ;D.NaClO3
(5)需要测定 和 的质量(填写化合物的化学式).
(6)选出测定过程中所需的基本操作 (按操作先后顺序列出).
A.萃取、分液 B.过滤、洗涤
C.蒸发、结品 D.冷却、称量 E.烘干或灼烧.

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有
A.容量瓶;B.烧杯;C.烧瓶
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是
A.控制溶液中Fe2+与Fe3+含量比; B.确定下一步还原所需铁的量
C.确定氧化Fe2+所需NaClO3的量; D.确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4+NaClO3+3H2SO4→3Fe2(SO4)3+NaCl+3H2O
若改用硝酸氧化,则反应方程式如下:
6FeSO4+2HNO3+3H2SO4→3Fe2(SO4)3+2NO↑+4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊.利是
聚合硫酸铁溶液中SO42-与Fe3+物质的量之比不是3:2.根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42-与Fe3+物质的量之比.
(4)测定时所需的试剂
A.NaOH; B.FeSO4 ;C.BaCl2 ;D.NaClO3
(5)需要测定
(6)选出测定过程中所需的基本操作
A.萃取、分液 B.过滤、洗涤
C.蒸发、结品 D.冷却、称量 E.烘干或灼烧.
分析:(1)根据配制一定量分数溶液的步骤:计算、称量、溶解,确定所用的仪器;
(2)为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,然后Fe2+再被氧化Fe3+;
(3)从环保和成本方面考虑;
(4)根据将SO42?与Fe3+都采用沉淀法加以测定;
(5)根据测定Fe2O3来测定Fe3+的物质的量,根据测定 BaSO4的质量来测定SO42?的物质的量考虑;
(6)根据测定沉淀的质量分析基本步骤;
(2)为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,然后Fe2+再被氧化Fe3+;
(3)从环保和成本方面考虑;
(4)根据将SO42?与Fe3+都采用沉淀法加以测定;
(5)根据测定Fe2O3来测定Fe3+的物质的量,根据测定 BaSO4的质量来测定SO42?的物质的量考虑;
(6)根据测定沉淀的质量分析基本步骤;
解答:解:(1)配制一定量质量分数硫酸溶液需要的仪器有:胶头滴管、量筒、玻璃棒、烧杯,故选:B;
(2)因为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,所以确定下一步还原所需铁的量,然后Fe2+再被氧化Fe3+,需要确定氧化Fe2+所需NaClO3的量.
故答案为:BC;
(3)从环保和成本方面考虑,利是原料成本较低,弊是产生气体对大气有污染;
故答案为:原料成本低,产生的气体对大气有污染;
(4)因SO42-与Fe3+都采用沉淀法加以测定,选择氢氧化钠沉淀铁离子,钡离子沉淀硫酸根离子,称量沉淀质量计算;
故答案为:AC.
(5)根据测定Fe2O3测定Fe3+的物质的量,根据测定 BaCl2的质量来测定SO42?的物质的量,需要测定Fe2O3 和BaSO4 的质量;
故答案为;Fe2O3,BaSO4;
(6)从溶液中获得沉淀,要先过滤、洗涤,烘干,冷却再称量沉淀质量,根据沉淀质量再进行计算即可.
故答案为:BED
(2)因为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,所以确定下一步还原所需铁的量,然后Fe2+再被氧化Fe3+,需要确定氧化Fe2+所需NaClO3的量.
故答案为:BC;
(3)从环保和成本方面考虑,利是原料成本较低,弊是产生气体对大气有污染;
故答案为:原料成本低,产生的气体对大气有污染;
(4)因SO42-与Fe3+都采用沉淀法加以测定,选择氢氧化钠沉淀铁离子,钡离子沉淀硫酸根离子,称量沉淀质量计算;
故答案为:AC.
(5)根据测定Fe2O3测定Fe3+的物质的量,根据测定 BaCl2的质量来测定SO42?的物质的量,需要测定Fe2O3 和BaSO4 的质量;
故答案为;Fe2O3,BaSO4;
(6)从溶液中获得沉淀,要先过滤、洗涤,烘干,冷却再称量沉淀质量,根据沉淀质量再进行计算即可.
故答案为:BED
点评:本题考查学生对实验方案的理解和设计,溶液配制,注意基础知识的掌握,题目难度中等.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目

 要的用途。
要的用途。 ,以吸附重金属离子。则PFS的中心原子未成对电子数为__ 个。
,以吸附重金属离子。则PFS的中心原子未成对电子数为__ 个。 ____ 。
____ 。