题目内容
工业上由金红石(TiO2)制取单质Ti,涉及的步骤为:
TiO2
TiCl4
Ti
(1)写出步骤ⅡTiCl4→Ti的化学方程式
(2)已知:①C(s)+O2(g)=CO2(g),△H=-393.5kJ?mol-1
②2CO+O2(g)=2CO2(g),△H=-566kJ?mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g),△H=+141kJ?mol-1
则反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=
TiO2
| 步骤Ⅰ |
| Mg,800℃,Ar |
| 步骤II |
(1)写出步骤ⅡTiCl4→Ti的化学方程式
2Mg+TiCl4
Ti+2MgCl2
| ||
| Ar |
2Mg+TiCl4
Ti+2MgCl2
.
| ||
| Ar |
(2)已知:①C(s)+O2(g)=CO2(g),△H=-393.5kJ?mol-1
②2CO+O2(g)=2CO2(g),△H=-566kJ?mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g),△H=+141kJ?mol-1
则反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=
-80
-80
kJ?mol-1.分析:(1)依据反应步骤和反应条件分析反应物和产物,根据原子守恒写出化学方程式;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式得到.
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式得到.
解答:解:(1)步骤ⅡTiCl4→Ti的化学方程式为:2Mg+TiCl4
Ti+2MgCl2;
故答案为:2Mg+TiCl4
Ti+2MgCl2;
(2)①C(s)+O2(g)=CO2(g)△H=-393.5KJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566KJ/L
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g)△H=+141KJ/mol;
依据盖斯定律①×2-②+③得到:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=-80KJ/mol;
故答案为:-80.
| ||
| Ar |
故答案为:2Mg+TiCl4
| ||
| Ar |
(2)①C(s)+O2(g)=CO2(g)△H=-393.5KJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566KJ/L
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g)△H=+141KJ/mol;
依据盖斯定律①×2-②+③得到:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=-80KJ/mol;
故答案为:-80.
点评:本题考查了热化学方程式的书写方法,盖斯定律的计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 常温下钛的化学活性很小,在较高温度下可与多种物质反应.
常温下钛的化学活性很小,在较高温度下可与多种物质反应.


 ,下列说法正确的是 。
,下列说法正确的是 。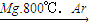 (步骤Ⅱ)Ti
(步骤Ⅱ)Ti