题目内容
(2011?东城区二模)为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.煤综合利用的一种途径如下所示: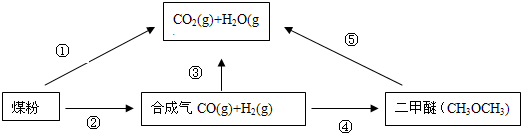
(1)用图所示装置定量检测过程①产生的CO2(已知:煤粉燃烧过程中会产生SO2)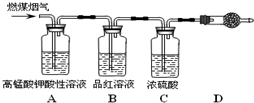
B中预期的实验现象是
(2)已知C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ?mol-1
C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+90kJ?mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是
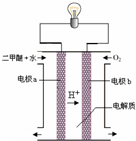
(3)用图装置可以完成⑤的转化,同时提高能量的利用率.其实现的能量转化形式主要是
(4)燃煤烟气中的CO2可用稀氨水捕获和吸收,不仅可以减少CO2的排放,也可以生产化肥碳酸氢铵.假设该方法每小时处理含CO2的体积分数为11.2%的燃煤烟气1000m3(标准状况),其中CO2的脱除效率为80%,则理论上每小时生产碳酸氢铵

(1)用图所示装置定量检测过程①产生的CO2(已知:煤粉燃烧过程中会产生SO2)

B中预期的实验现象是
品红溶液不变色
品红溶液不变色
,D中的试剂是碱石灰
碱石灰
.(2)已知C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ?mol-1
C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+90kJ?mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.3kJ?mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.3kJ?mol-1
,该反应的化学平衡常数K随温度的升高将减小
减小
(填“增大”、“减小”或“不变”).(3)用图装置可以完成⑤的转化,同时提高能量的利用率.其实现的能量转化形式主要是
化学能转化为电能
化学能转化为电能
,a的电极反应式是CH3OCH3+3H2O-12e-=2CO2↑+12H+
CH3OCH3+3H2O-12e-=2CO2↑+12H+
.
(4)燃煤烟气中的CO2可用稀氨水捕获和吸收,不仅可以减少CO2的排放,也可以生产化肥碳酸氢铵.假设该方法每小时处理含CO2的体积分数为11.2%的燃煤烟气1000m3(标准状况),其中CO2的脱除效率为80%,则理论上每小时生产碳酸氢铵
316
316
kg.分析:(1)根据燃煤烟气的成分为CO2、SO2、CO、H2O,酸性高锰酸钾能够除去SO2,CO2、CO、H2O不能使品红溶液褪色,浓硫酸可以吸水;根据碱石灰能够吸收CO2;
(2)根据盖斯定律来解答;根据温度对化学平衡的影响来判断平衡常数K的变化;
(3)根据原电池将化学能转变成电能;根据负极的电极反应=总反应-正极的电极反应;
(4)根据方程式:CO2+NH3?H2O=NH4HCO3来计算.
(2)根据盖斯定律来解答;根据温度对化学平衡的影响来判断平衡常数K的变化;
(3)根据原电池将化学能转变成电能;根据负极的电极反应=总反应-正极的电极反应;
(4)根据方程式:CO2+NH3?H2O=NH4HCO3来计算.
解答:解:(1)燃煤烟气的成分为CO2、SO2、CO、H2O,酸性高锰酸钾能够除去SO2,CO2、CO、H2O不能使品红溶液褪色,碱石灰能够吸收CO2,故答案为:品红溶液不变色;碱石灰;
(2)C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ?mol-1 ①
C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+90kJ?mol-1 ②
由盖斯定律②-①得:
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.3kJ?mol-1
升高温度平衡向吸热的方向移动,而该反应正反应为放热,故逆向移动,平衡常数K减小,
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.3kJ?mol-1;减小;
(3)原电池将化学能转变成电能,正极:3O2+12e-+12H+=6H2O,总反应:CH3OCH3+3O2=2CO2↑+3H2O,负极的电极反应=总反应-正极的电极反应=CH3OCH3+3H2O-12e-=2CO2↑+12H+,
故答案为:化学能转变成电能;CH3OCH3+3H2O-12e-=2CO2↑+12H+;
(4)由 CO2 +NH3?H2O=NH4HCO3
1 1
4000mol
所以NH4HCO3 的质量为:4000mol×79g/mol=316000g=316kg,故答案为:316.
(2)C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ?mol-1 ①
C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+90kJ?mol-1 ②
由盖斯定律②-①得:
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.3kJ?mol-1
升高温度平衡向吸热的方向移动,而该反应正反应为放热,故逆向移动,平衡常数K减小,
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.3kJ?mol-1;减小;
(3)原电池将化学能转变成电能,正极:3O2+12e-+12H+=6H2O,总反应:CH3OCH3+3O2=2CO2↑+3H2O,负极的电极反应=总反应-正极的电极反应=CH3OCH3+3H2O-12e-=2CO2↑+12H+,
故答案为:化学能转变成电能;CH3OCH3+3H2O-12e-=2CO2↑+12H+;
(4)由 CO2 +NH3?H2O=NH4HCO3
1 1
| 1000×103L×11.2%×80% |
| 22.4L/mol |
所以NH4HCO3 的质量为:4000mol×79g/mol=316000g=316kg,故答案为:316.
点评:本题以煤资源为背景,考查的知识点较多,综合性较强,是一道好题,熟悉盖斯定律计算反应热、电化学等知识即可解答.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目