摘要:核外电子排布.推导化学式(近10年来的化学高考命题中的呈现率:100%) [点题] 镓是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝 元素.镓的原子序数为31.属ⅢA族.镓的熔点为29.78℃,沸点高达2403℃.镓有过冷现象.它可过冷到-120℃.由此判断下列有关镓的性质及其用途的叙述不正确的是 A.镓是制造高温温度计的上佳材料 B. 镓能溶于强酸和强碱中 C.镓与锌.锡.铟等金属制成的合金.可用在自动救火的水龙头中 D.近年来镓成为电子工业的新宠.其主要用途是制造半导体材料.被誉为“半导体材料的新粮食 .这是利用了镓的导电性介于导体和绝缘体之间的性质 [点晴] D . [点题] 法国里昂的科学家最近发现一种只由四个中子构成的粒子.这种粒子称为“四中子 .也有人称之为“零号元素 .下列有关“四中子 粒子的说法不正确的是 A.该粒子不显电性 B.该粒子质量数为4 C.在周期表中与氢元素占同一位置 D.该粒子质量比氢原子大 [点晴] C. [点题] A.B两元素的原子分别得到2个电子形成稳定结构时.A放出的能量大于B放出的能量,C.D两元素的原子分别失去1个电子形成稳定结构时.D吸收的能量大于C吸收的能量.若A.B.C.D间分别形成化合物.属于离子化合物的可能性最大的是 A.D2A B.C2B C.C2A D.D2B [点晴]本题考察金属.非金属元素原子结构特征.离子化合物形成特点及与能量的关系.要善于从能量的变化来判断金属性.非金属性的强弱.根据A.B得2个电子.C.D失1个电子均达稳定结构.判断A.B为ⅥA族元素.再根据能量越低越稳定的原则.A形成稳定离子时放出能量大于B.说明A非金属性强于B.C形成稳定离子时吸收能量小于D.说明C金属性强于D.所以C.A最易形成离子化合物C2A.能量越低越稳定的原则是化学变化中的基本原则.但同学们对这一点很不敏感.在今后的学习中应注意这一问题.故选C. [点题]下列六种化合物(A-F)中含有的元素不多于三种.且分子内所含X.Y元素的质量分数及化合物的部分性质列于下表. 化合物 A B C D E F ω(x) 0.1653 0.2069 0.2781 0.4211 0.8743 0.2089 ω(y) 0.8347 0.7852 0.7019 0.5338 0 0.7911 常压下t℃的 密度g/cm3 1.448 1.145 1.42 2.97×10-3 (0℃) 0.68 - 沸点/℃ 57 30.4 8.3 -12 -111.8 145 熔点/℃ -70.4 -118 -122 -130 -185 3 分子极性 非极性 极性 极性 极性 非极性 - 根据上表有关信息回答下列问题:计算化合物D的相对分子质量. 确定六种化合物的化学式.写出推理和计算过程. [点晴] 要点之一:D中所含的另一种元素的总式量为:66.5×=3,元素的相对原子质量比3小的唯有H元素.故D分子中必有3个氢原子.要点之二:据要点之一.推定E为氢化物.设其分子式为XHn ,X的相对原子质量为a,则:.a=7n.经讨论.当n=4.a=28时符合题意.因此X为Si 要点之三:据要点一与要点二可立即假设D为SiH3Y. 要点之四:设Y的相对原子质量为b, 据 得b=35.5.故Y是Cl 要点之五:由F中X.Y的质量分数.可求得其最简式为SiCl3.从价态不难得出F的分子式为Si2Cl6.因此各物质分别为:A.SiCl4, B.SiHCl3, C.SiH2Cl2, D.SiH3Cl, E.SiH4, F.Si2Cl6
网址:http://m.1010jiajiao.com/timu3_id_46018[举报]
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C是同一周期相邻的三种元素,B、D、F元素原子最外电子层的p能级(轨道)上的电子均处于半满状态,元素E的最高正价氧化物的水化物在同周期元素的最高正价氧化物的水化物中酸性最强.
请回答下列问题:
(1)A、B、C三元素的第一电离能由大到小的顺序为 (用对应的元素符号填空,下空同),三者的电负性由大到小的顺序为
(2)A、B、C三元素的氢化物分子的空间结构分别是
(3)B、D、F三元素的氢化物的沸点从高到低排列次序是(填化学式) ,其原因是 .
(4)F元素原子基态时的核外电子排布式为 .
(5)由B、E两种元素组成的化合物X,常温下为易挥发的淡黄色液体,x分子为三角锥形分子,且分子里B、E两种原子最外层均达到8个电子的稳定结构.X遇水蒸气可形成一种常见的漂白性物质,则X分子的电子式为 ,X分子的中心原子的杂化轨道类型为 ,X与水反应的化学方程式是 .
(6)另有一种位于周期表中ds区的元素G,该元素单质形成的晶体晶胞如图所示,若假设该原子半径为r,相对原子质量为Mr,则该元素单质的密度可表示为 .(用NA表示阿伏加德罗常数)
查看习题详情和答案>>
请回答下列问题:
(1)A、B、C三元素的第一电离能由大到小的顺序为
(2)A、B、C三元素的氢化物分子的空间结构分别是
(3)B、D、F三元素的氢化物的沸点从高到低排列次序是(填化学式)
(4)F元素原子基态时的核外电子排布式为
(5)由B、E两种元素组成的化合物X,常温下为易挥发的淡黄色液体,x分子为三角锥形分子,且分子里B、E两种原子最外层均达到8个电子的稳定结构.X遇水蒸气可形成一种常见的漂白性物质,则X分子的电子式为

(6)另有一种位于周期表中ds区的元素G,该元素单质形成的晶体晶胞如图所示,若假设该原子半径为r,相对原子质量为Mr,则该元素单质的密度可表示为
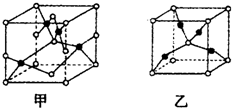 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态. 请填写下列空白.
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态. 请填写下列空白.(1)E元素基态原子的核外电子排布式为
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为
(3)B2A4是重要的基本石油化工原料.B2A4分子中B原子轨道的杂化类型为
(4)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.(1)A、B、C、D、E元素最高价氧化物对应水化物的酸性由强到弱的顺序为(用化学式表示)
(2)E元素的常见阴离子的核外电子排布式为
(3)右图是E和Fe形成的晶体FeE2的最小单元“晶胞”,FeE2晶体中阴、阳离子数之比为
(2010?海南)I下列描述中正确的是
A、CS2为V形的极性分子
B、Cl03- 的空间构型为平面三角形
C、SF6中有6对完全相同的成键电子对
D、SiF4和SO32- 的中心原子均为sp3杂化
Ⅱ金属镍及其化合物在合金材料以及催化剂等方面应用广泛.请回答下列问题:
(1)Ni原子的核外电子排布式为
(2)Ni0、Fe0的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO
(3)Ni0晶胞中Ni和O的配位数分别为
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示.该合金的化学式为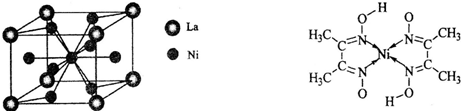
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示.
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是
②该结构中,氧氢之间除共价键外还可存在
③该结构中,碳原子的杂化轨道类型有
查看习题详情和答案>>
C、D
C、D
A、CS2为V形的极性分子
B、Cl03- 的空间构型为平面三角形
C、SF6中有6对完全相同的成键电子对
D、SiF4和SO32- 的中心原子均为sp3杂化
Ⅱ金属镍及其化合物在合金材料以及催化剂等方面应用广泛.请回答下列问题:
(1)Ni原子的核外电子排布式为
1s22s22p63s23p63d84s2
1s22s22p63s23p63d84s2
;(2)Ni0、Fe0的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO
>
>
FeO(填“<”或“>”);(3)Ni0晶胞中Ni和O的配位数分别为
6
6
、6
6
;(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示.该合金的化学式为
LaNi5
LaNi5
;
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示.
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是
一个σ键、一个π键
一个σ键、一个π键
,氮镍之间形成的化学键是配位键
配位键
;②该结构中,氧氢之间除共价键外还可存在
氢键
氢键
;③该结构中,碳原子的杂化轨道类型有
sp2、sp3
sp2、sp3
. 尿素(H2NCONH2)可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)].
尿素(H2NCONH2)可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)].(1)基态Fe3+的核外电子排布式为
1s22s22p63s23p63d5
1s22s22p63s23p63d5
.C、N、O三种元素的第一电离能由大到小的顺序是N>O>C
N>O>C
.(2)尿素分子中C、N原子的杂化方式分别是
sp2、sp3
sp2、sp3
.(3)[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是
配位键
配位键
.与NO3-互为等电子体的一种化合物是SO3等
SO3等
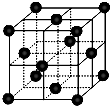
(写化学式).(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如图所示.
①1个CO2分子周围等距离且距离最近的CO2分子有
12
12
个.②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是
1:3
1:3
.