题目内容
(2012?太原一模)X、Y、Z、U、W为原子序数依次增大的前四周期元素,X、Y、Z三种元素的基态原子具有相同的能层和能级,且第一电离能:I1(X)<I1(Z)<I1(Y),其中基态Y原子的2p轨道处于半充满状态,且XZ2与Y2Z互为等电子体.U为周期表前四周期中电负性最小的元素,W的原子序数为26.试回答下列问题:
(1)XZ2的电子式为
 ,基态W原子的核外电子排布式为
,基态W原子的核外电子排布式为
(2)Y的简单氢化物极易溶于Z的简单氢化物中,其主要原因是
(3)X的一种氢化物的相对分子质量为26,其分子中σ键与π键的键数之比为
(4)化合物甲由Z、U两元素组成,其晶胞如图所示.
①甲的化学式为
②下列有关该晶体的说法正确的是
A.每个晶胞中含有14个U+和13个Z-2
B.晶体中每个U+周围距离U+最近的Z-2有8个
C.晶体中与每个U+距离最近的U+有12个
D.该晶体属于离子晶体
③甲的密度为a g?cm-3,则晶胞的体积是
cm3(只要求列出计算式,阿伏加德罗常数用NA表示).
(1)XZ2的电子式为


1s22s22p63s23p63d64s2
1s22s22p63s23p63d64s2
.(2)Y的简单氢化物极易溶于Z的简单氢化物中,其主要原因是
这两种氢化物均为极性分子,氨气和水分子之间能形成氢键
这两种氢化物均为极性分子,氨气和水分子之间能形成氢键
.(3)X的一种氢化物的相对分子质量为26,其分子中σ键与π键的键数之比为
3:2
3:2
;其分子中X原子的杂化轨道类型为sp
sp
.
(4)化合物甲由Z、U两元素组成,其晶胞如图所示.
①甲的化学式为
KO2
KO2
②下列有关该晶体的说法正确的是
CD
CD
(填字母编号).A.每个晶胞中含有14个U+和13个Z-2
B.晶体中每个U+周围距离U+最近的Z-2有8个
C.晶体中与每个U+距离最近的U+有12个
D.该晶体属于离子晶体
③甲的密度为a g?cm-3,则晶胞的体积是
| 284 |
| aNA |
| 284 |
| aNA |
分析:X、Y、Z、U、W为原子序数依次增大的前四周期元素,X、Y、Z三种元素的基态原子具有相同的能层和能级,且第一电离能:I1(X)<I1(Z)<I1(Y),且XZ2与Y2Z互为等电子体,其中基态Y原子的2p轨道处于半充满状态,则Y是N元素,X的原子序数小于Y且其能层和能级相同,所以X是C元素,Z的原子序数大于Y,Z是O元素,U为周期表前四周期中电负性最小的元素,说明U的金属性最强,则U是K元素,W的原子序数为26,为Fe元素,结合元素、物质的结构和性质分析解答.
解答:解:X、Y、Z、U、W为原子序数依次增大的前四周期元素,X、Y、Z三种元素的基态原子具有相同的能层和能级,且第一电离能:I1(X)<I1(Z)<I1(Y),且XZ2与Y2Z互为等电子体,其中基态Y原子的2p轨道处于半充满状态,则Y是N元素,X的原子序数小于Y且其能层和能级相同,所以X是C元素,Z的原子序数大于Y,Z是O元素,U为周期表前四周期中电负性最小的元素,说明U的金属性最强,则U是K元素,W的原子序数为26,为Fe元素,
(1)CO2分子中碳原子和每个氧原子形成两个共价键,所以二氧化碳的电子式为 ,W是Fe元素,其原子核外有26个电子,根据构造原理知,基态W原子的核外电子排布式为1s22s22p63s23p63d64s2,
,W是Fe元素,其原子核外有26个电子,根据构造原理知,基态W原子的核外电子排布式为1s22s22p63s23p63d64s2,
故答案为: ;1s22s22p63s23p63d64s2;
;1s22s22p63s23p63d64s2;
(2)Y的简单氢化物是氨气,Z的简单氢化物是水,氨气和水都是极性分子,根据相似相溶原理知,氨气极易溶于水,且氨气和水之间易形成氢键,氢键的存在导致氨气的溶解性较大,
故答案为:这两种氢化物均为极性分子,氨气和水分子之间能形成氢键;
(3)C的一种氢化物的相对分子质量为26,则其氢化物是HC≡CH,乙炔分子中含有3个σ键与2个π键,所以乙炔分子中σ键与π键的键数之比为3:2;其分子中C原子的杂化轨道类型为sp,
故答案为:3:2;sp;
(4)化合物甲由O、K两元素组成,
①利用均摊法得,K原子个数=8×
+6×
=4,O原子个数=(12×
+1)×2=8,所以K、O原子个数之比为1:2,则甲的化学式为KO2,
故答案为:KO2;
②A.每个晶胞中含有4个U+和8个O2-,故错误;
B.晶体中每个K+周围距离K+最近的O2-有6个,故错误;
C.晶体中与每个K+距离最近的K+个数=3×8×
=12,故正确;
D.该晶体的构成微粒是阴阳离子,所以属于离子晶体,故正确;
故选CD;
③甲的密度为a g?cm-3,KO2的密度为a g?cm-3,体积V=
cm3=
cm3,
故答案为:
.
(1)CO2分子中碳原子和每个氧原子形成两个共价键,所以二氧化碳的电子式为
 ,W是Fe元素,其原子核外有26个电子,根据构造原理知,基态W原子的核外电子排布式为1s22s22p63s23p63d64s2,
,W是Fe元素,其原子核外有26个电子,根据构造原理知,基态W原子的核外电子排布式为1s22s22p63s23p63d64s2,故答案为:
 ;1s22s22p63s23p63d64s2;
;1s22s22p63s23p63d64s2;(2)Y的简单氢化物是氨气,Z的简单氢化物是水,氨气和水都是极性分子,根据相似相溶原理知,氨气极易溶于水,且氨气和水之间易形成氢键,氢键的存在导致氨气的溶解性较大,
故答案为:这两种氢化物均为极性分子,氨气和水分子之间能形成氢键;
(3)C的一种氢化物的相对分子质量为26,则其氢化物是HC≡CH,乙炔分子中含有3个σ键与2个π键,所以乙炔分子中σ键与π键的键数之比为3:2;其分子中C原子的杂化轨道类型为sp,
故答案为:3:2;sp;
(4)化合物甲由O、K两元素组成,
①利用均摊法得,K原子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
故答案为:KO2;
②A.每个晶胞中含有4个U+和8个O2-,故错误;
B.晶体中每个K+周围距离K+最近的O2-有6个,故错误;
C.晶体中与每个K+距离最近的K+个数=3×8×
| 1 |
| 2 |
D.该晶体的构成微粒是阴阳离子,所以属于离子晶体,故正确;
故选CD;
③甲的密度为a g?cm-3,KO2的密度为a g?cm-3,体积V=
| ||
| a |
| 284 |
| aNA |
故答案为:
| 284 |
| aNA |
点评:本题考查了元素位置结构的关系,正确推断元素是解本题关键,涉及晶胞的计算、杂化方式的判断、原子核外电子排布式的书写等知识点,难点的晶胞体积的计算,难度中等.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
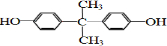
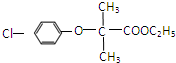 :和某聚碳酸酯工程塑料(
:和某聚碳酸酯工程塑料( )的原料之一.
)的原料之一.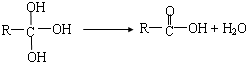





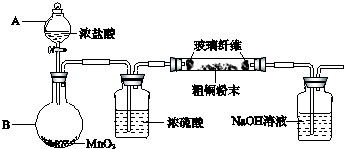
 CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l)