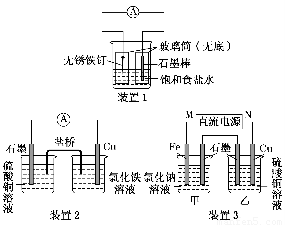
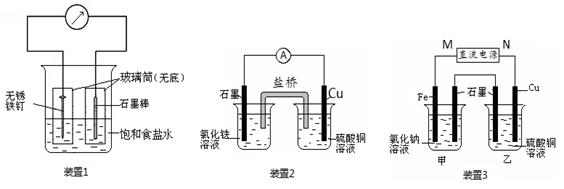
题目内容
 分别回答下列问题.
分别回答下列问题.(1)从H+、Na+、Cu2+、Cl-、S
| O | 2- 4 |
①电解过程中溶液颜色变浅且水量不变
CuCl2
CuCl2
;②电解过程中电解质含量不变,水量减少
H2SO4或Na2SO4
H2SO4或Na2SO4
;③电解过程中,两极析出气体的体积比为1:1
HCl或NaCl
HCl或NaCl
.(2)①用惰性电极电解硫酸铜溶液,若阴极上有1.6克铜析出,则阳极上产生的气体在标准状况下的体积约为
0.28L
0.28L
;②用铂电极电解0.02mol/L硫酸铜溶液,直至铜完全析出,所得溶液中氢离子浓度为(忽略溶液体积的变化)
0.04mol/L
0.04mol/L
;③已知下列两个热化学方程式2H2(g)+O2(g)=2H2O(1)△H=-571.6KJ;C3H8(g)+5O2(g)=3CO2(g)+4H2O(1)△H=-2220.0kJ实验测得,5mol氢气和丙烷的混合气体完全燃烧时放热3847kJ,则混合气体中氢气与丙烷的体积比是
3:1
3:1
.(3)如图所示,甲、乙两试管中各放一枚铁钉,甲试管中为NaCl溶液,乙试管为稀醋酸溶液,数天后观察到的现象
是
U形管左端液面上升,右边液面下降
U形管左端液面上升,右边液面下降
,甲中正极反应为O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
,乙中正极反应为2H++2e-=H2↑
2H++2e-=H2↑
.分析:(1)①惰性电极电解CuCl2溶液时,溶液颜色变浅,水量不变;
②惰性电极电解H2SO4(或Na2SO4)溶液时,电解质质量不变,水量减少;
③电解过程中,两极析出气体的体积比为1:1,应分别生成氢气和氯气;
(2)电解硫酸铜溶液,阳极发生4OH--4e-=2H2O+O2↑,阴极发生Cu2++2e-=Cu,以此解答①②,根据反应热计算混合物;
(3)甲发生吸氧腐蚀,乙发生析氢腐蚀.
②惰性电极电解H2SO4(或Na2SO4)溶液时,电解质质量不变,水量减少;
③电解过程中,两极析出气体的体积比为1:1,应分别生成氢气和氯气;
(2)电解硫酸铜溶液,阳极发生4OH--4e-=2H2O+O2↑,阴极发生Cu2++2e-=Cu,以此解答①②,根据反应热计算混合物;
(3)甲发生吸氧腐蚀,乙发生析氢腐蚀.
解答:解:(1)因阳离子放电顺序为Cu2+>Na+>H+,阴离子放电顺序为Cl->OH->SO42-,
①惰性电极电解CuCl2溶液时,铜离子、氯离子放电,则电解质质量减小,溶液颜色变浅,水量不变,故答案为:CuCl2;
②惰性电极电解H2SO4(或Na2SO4)溶液时,氢离子、氢氧根离子放电,则电解质质量不变,水量减少,故答案为:H2SO4或Na2SO4;
③电解过程中,两极析出气体的体积比为1:1,应分别生成氢气和氯气,应为HCl或NaCl,故答案为:HCl或NaCl;
(2)电解硫酸铜溶液,阳极发生4OH--4e-=2H2O+O2↑,阴极发生Cu2++2e-=Cu,
①若阴极上有1.6克铜析出,n(Cu)=
=0.025mol,则转移电子为0.05mol,阳极生成n(O2)=
×0.05mol=0.0125mol,
V(O2)=0.0125mol×22.4L/mol=0.28L,故答案为:0.28L;
②用铂电极电解0.02mol/L硫酸铜溶液,直至铜完全析出,由2H+~2OH-~Cu2+可知,所得溶液中氢离子浓度为0.04mol/L,
故答案为:0.04mol/L;
③设混合气体中含有xmol氢气,则丙烷为(5-x)mol,则有
x+(5-x)×2220.0=3847,解之得x=3.75,
则混合气体中氢气与丙烷的体积比为3.75:1.25=3:1,
故答案为:3:1;
(3)甲发生吸氧腐蚀,正极反应为O2+2H2O+4e-═4OH-,乙发生析氢腐蚀,正极反应为2H++2e-=H2↑,可观察到U形管左端液面上升,右边液面下降,
故答案为:U形管左端液面上升,右边液面下降;O2+2H2O+4e-═4OH-;2H++2e-=H2↑.
①惰性电极电解CuCl2溶液时,铜离子、氯离子放电,则电解质质量减小,溶液颜色变浅,水量不变,故答案为:CuCl2;
②惰性电极电解H2SO4(或Na2SO4)溶液时,氢离子、氢氧根离子放电,则电解质质量不变,水量减少,故答案为:H2SO4或Na2SO4;
③电解过程中,两极析出气体的体积比为1:1,应分别生成氢气和氯气,应为HCl或NaCl,故答案为:HCl或NaCl;
(2)电解硫酸铜溶液,阳极发生4OH--4e-=2H2O+O2↑,阴极发生Cu2++2e-=Cu,
①若阴极上有1.6克铜析出,n(Cu)=
| 1.6g |
| 64g/mol |
| 1 |
| 4 |
V(O2)=0.0125mol×22.4L/mol=0.28L,故答案为:0.28L;
②用铂电极电解0.02mol/L硫酸铜溶液,直至铜完全析出,由2H+~2OH-~Cu2+可知,所得溶液中氢离子浓度为0.04mol/L,
故答案为:0.04mol/L;
③设混合气体中含有xmol氢气,则丙烷为(5-x)mol,则有
| 571.6 |
| 2 |
则混合气体中氢气与丙烷的体积比为3.75:1.25=3:1,
故答案为:3:1;
(3)甲发生吸氧腐蚀,正极反应为O2+2H2O+4e-═4OH-,乙发生析氢腐蚀,正极反应为2H++2e-=H2↑,可观察到U形管左端液面上升,右边液面下降,
故答案为:U形管左端液面上升,右边液面下降;O2+2H2O+4e-═4OH-;2H++2e-=H2↑.
点评:本题考查较为综合,涉及电解原理和化学反应与能量的变化、金属的腐蚀与防护等知识,主要是考查学生对电解原理应用的了解掌握情况,有利于培养学生的逻辑推理能力,提高学生的学习效率.该题需要明确的是在判断电解产物时,首先判断阳极电极材料.如果是活性电极,则电极本身失去电子.如果是惰性电极,则溶液中的阴离子失去电子.而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目