摘要: ACB2为离子化合物,ACB2的质子总数为20.A+和CB2⁻的电子总数相等.C原子核外有3个未成对电子.A.B原子最外层电子排布均为ns1.该化合物会发生强烈水解.水溶液呈碱性.其水解的离子方程式为
网址:http://m.1010jiajiao.com/timu3_id_435140[举报]
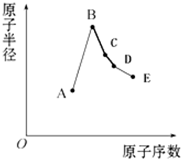 短周期元素中:A是地壳中含量最高的元素;B比Ne的质子数多1个;C最外层电子数与其电子层数相等;D单质是半导体材料;E非金属性在同周期元素中最强.下列说法中正确的是( )
短周期元素中:A是地壳中含量最高的元素;B比Ne的质子数多1个;C最外层电子数与其电子层数相等;D单质是半导体材料;E非金属性在同周期元素中最强.下列说法中正确的是( )| A、B离子的半径比C离子的半径小 | B、A、B两单质反应可得到两种不同的离子化合物 | C、C单质与A或E单质形成的化合物均为离子化合物 | D、B最高价氧化物对应的水合物与D单质发生反应能产生气体 |
(2008?淮南一模)X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍.下列有关叙述正确的是( )
查看习题详情和答案>>
下列说法正确的是( )
| A、原子的种类是由原子核内质子数决定 | B、非金属元素的原子间不能形成离子化合物 | C、同素异形体在一定条件下的转化为化学变化 | D、酸能电离出H+和酸根离子,故酸为离子化合物 |
氮元素可形成多种离子,如N3-、N3-、NH2-、NH4+、N2H5+、N2H62+等.
(1)与N相邻的两种元素C、O,三者第一电离能由大到小为
(2)N≡N的键能为942kJ?mol-1,N-N单键的键能为247kJ?mol-1,说明N2中的
(3)液态氨可电离出NH2-.NH2-的电子式为
 .
.
(4)已知NH4H为离子化合物,写出其与重水D2O反应的生成物(加热)
(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图1所示.与同一个N3-相连的X+有
(6)最近科学家研制出某元素Z与N元素形成的晶体ZN,已知ZN晶体具有与NaCl相似的晶体结构.图2是从ZN晶体结构图中分割出来的部分结构图,试判断符合ZN晶体结构图的是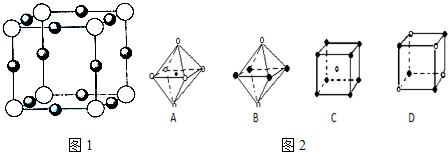
查看习题详情和答案>>
(1)与N相邻的两种元素C、O,三者第一电离能由大到小为
N>O>C
N>O>C
(2)N≡N的键能为942kJ?mol-1,N-N单键的键能为247kJ?mol-1,说明N2中的
π
π
键比σ
σ
键稳定(填“σ”或“π”).(3)液态氨可电离出NH2-.NH2-的电子式为


(4)已知NH4H为离子化合物,写出其与重水D2O反应的生成物(加热)
HD、NH3、HDO
HD、NH3、HDO
;Na3N也为离子化合物,则Na3N与水反应的化学方程式为Na3N+3H2O=NH3↑+3NaOH
Na3N+3H2O=NH3↑+3NaOH
,反应类型为水解反应
水解反应
.(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图1所示.与同一个N3-相连的X+有
6
6
个.X原子的基态电子排布式为1s22s22p63s23p63d104S1
1s22s22p63s23p63d104S1
(6)最近科学家研制出某元素Z与N元素形成的晶体ZN,已知ZN晶体具有与NaCl相似的晶体结构.图2是从ZN晶体结构图中分割出来的部分结构图,试判断符合ZN晶体结构图的是
AD
AD
.