题目内容
氮元素可形成多种离子,如N3-、N3-、NH2-、NH4+、N2H5+、N2H62+等.
(1)与N相邻的两种元素C、O,三者第一电离能由大到小为
(2)N≡N的键能为942kJ?mol-1,N-N单键的键能为247kJ?mol-1,说明N2中的
(3)液态氨可电离出NH2-.NH2-的电子式为
 .
.
(4)已知NH4H为离子化合物,写出其与重水D2O反应的生成物(加热)
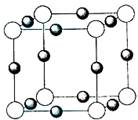
(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图1所示.与同一个N3-相连的X+有
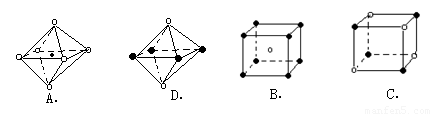
(6)最近科学家研制出某元素Z与N元素形成的晶体ZN,已知ZN晶体具有与NaCl相似的晶体结构.图2是从ZN晶体结构图中分割出来的部分结构图,试判断符合ZN晶体结构图的是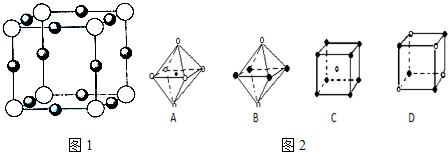
(1)与N相邻的两种元素C、O,三者第一电离能由大到小为
N>O>C
N>O>C
(2)N≡N的键能为942kJ?mol-1,N-N单键的键能为247kJ?mol-1,说明N2中的
π
π
键比σ
σ
键稳定(填“σ”或“π”).(3)液态氨可电离出NH2-.NH2-的电子式为


(4)已知NH4H为离子化合物,写出其与重水D2O反应的生成物(加热)
HD、NH3、HDO
HD、NH3、HDO
;Na3N也为离子化合物,则Na3N与水反应的化学方程式为Na3N+3H2O=NH3↑+3NaOH
Na3N+3H2O=NH3↑+3NaOH
,反应类型为水解反应
水解反应
.(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图1所示.与同一个N3-相连的X+有
6
6
个.X原子的基态电子排布式为1s22s22p63s23p63d104S1
1s22s22p63s23p63d104S1
(6)最近科学家研制出某元素Z与N元素形成的晶体ZN,已知ZN晶体具有与NaCl相似的晶体结构.图2是从ZN晶体结构图中分割出来的部分结构图,试判断符合ZN晶体结构图的是
AD
AD
.
分析:(1)同周期自左而右元素的第一电离能呈增大趋势,但N元素原子2p能级含有3个电子,为半满稳定状态,能量降低,比较稳定,失去第一个电子需要的能量更多;
(2)N≡N中含有2个π键,1个σ键,已知N≡N键能为942kJ/mol,N-N单键键能为247kJ/mol,则1个π键的键能为
kJ/mol=347.5kJ/mol,键能越高化学键越稳定,以此判断;
(3)NH2-可以看做NH3失去1个H+,N原子越H原子之间形成1对共用电子对,N原子有2对孤对电子对;
(4)NH4H为离子化合物,由铵根离子与氢负离子构成,与重水D2O发生水解反应,铵根离子与重水电离的阴离子结合,氢负离子与重水电离的阳离子结合;
Na3N为离子化合物,由钠离子与N3-构成,与水发生水解反应,N3-与水电离的氢离子结合,据此书写;
(5)X+中所有电子正好充满K、L、M三个电子层,故X元素原子核外电子数为2+8+18+1=29,为Cu元素,由晶胞结构可知,晶胞中白色球数目为8×
=1,黑色球为12×
=3,故白色球为N3-,黑色球为Cu+,以N3-为中心,在X、Y、Z三个轴上,在每个轴上等距离的Cu+有2个,根据核外电子排布规律书写Cu原子的基态电子排布式;
(6)根据氯化钠晶体中钠离子或氯离子的配位数判断其结构图是否正确,钠离子或氯离子的配位数都是6.
(2)N≡N中含有2个π键,1个σ键,已知N≡N键能为942kJ/mol,N-N单键键能为247kJ/mol,则1个π键的键能为
| 942-247 |
| 2 |
(3)NH2-可以看做NH3失去1个H+,N原子越H原子之间形成1对共用电子对,N原子有2对孤对电子对;
(4)NH4H为离子化合物,由铵根离子与氢负离子构成,与重水D2O发生水解反应,铵根离子与重水电离的阴离子结合,氢负离子与重水电离的阳离子结合;
Na3N为离子化合物,由钠离子与N3-构成,与水发生水解反应,N3-与水电离的氢离子结合,据此书写;
(5)X+中所有电子正好充满K、L、M三个电子层,故X元素原子核外电子数为2+8+18+1=29,为Cu元素,由晶胞结构可知,晶胞中白色球数目为8×
| 1 |
| 8 |
| 1 |
| 4 |
(6)根据氯化钠晶体中钠离子或氯离子的配位数判断其结构图是否正确,钠离子或氯离子的配位数都是6.
解答:解:(1)同周期自左而右元素的第一电离能呈增大趋势,但N元素原子2p能级含有3个电子,为半满稳定状态,能量降低,比较稳定,失去第一个电子需要的能量更多,故第一电离能N>O>C,故答案为:N>O>C;
(2)N≡N中含有2个π键,1个σ键,已知N≡N键能为942kJ/mol,N-N单键键能为247kJ/mol,则1个π键的键能为
kJ/mol=347.5kJ/mol,则N2中的π键键能大于σ键键能,π键较稳定,故答案为:π;σ;
(3)NH2-可以看做NH3失去1个H+,N原子越H原子之间形成1对共用电子对,N原子有2对孤对电子对,NH2-电子式为 ,故答案为:
,故答案为: ;
;
(4)NH4H为离子化合物,与重水D2O加热发生反应NH4H+D2O
HD↑+NH3↑+HDO;
Na3N也为离子化合物,Na3N与水反应的化学方程式为 Na3N+3H2O=NH3↑+3NaOH,属于水解反应,
故答案为:HD、NH3、HDO,Na3N+3H2O=NH3↑+3NaOH,水解反应;
(5)X+中所有电子正好充满K、L、M三个电子层,故X元素原子核外电子数为2+8+18+1=29,为Cu元素,由晶胞结构可知,晶胞中白色球数目为8×
=1,黑色球为12×
=3,故白色球为N3-,黑色球为Cu+,以N3-为中心,在X、Y、Z三个轴上,在每个轴上等距离的Cu+有2个,故故同一个N3-相连的X+有6个,
铜为29号元素,原子核外电子排布式为:1s22s22p63s23p63d104S1,
故答案为:6,1s22s22p63s23p63d104S1;
(5)一个晶胞中阳离子的个数为12×=3,阴离子个数为:8×=1,然后求出两者的个数之比为3:1;根据以Xn-为中心,在X、Y、Z三个轴上,在每个轴上等距离的C+有2个,共6个
(6)由于在NaCl晶体中,每个Na+周围同时吸引着最近的等距离的6个Cl-同样每个Cl-周围同时吸引着最近的等距离的6个Na+,图A符合条件,图D中选取其中一个离子,然后沿X、Y、Z三轴切割得到6个等距离的且最近的带相反电荷的离子,所以其配位数也是6,故符合条件,故答案为:AD.
(2)N≡N中含有2个π键,1个σ键,已知N≡N键能为942kJ/mol,N-N单键键能为247kJ/mol,则1个π键的键能为
| 942-247 |
| 2 |
(3)NH2-可以看做NH3失去1个H+,N原子越H原子之间形成1对共用电子对,N原子有2对孤对电子对,NH2-电子式为
 ,故答案为:
,故答案为: ;
;(4)NH4H为离子化合物,与重水D2O加热发生反应NH4H+D2O
| ||
Na3N也为离子化合物,Na3N与水反应的化学方程式为 Na3N+3H2O=NH3↑+3NaOH,属于水解反应,
故答案为:HD、NH3、HDO,Na3N+3H2O=NH3↑+3NaOH,水解反应;
(5)X+中所有电子正好充满K、L、M三个电子层,故X元素原子核外电子数为2+8+18+1=29,为Cu元素,由晶胞结构可知,晶胞中白色球数目为8×
| 1 |
| 8 |
| 1 |
| 4 |
铜为29号元素,原子核外电子排布式为:1s22s22p63s23p63d104S1,
故答案为:6,1s22s22p63s23p63d104S1;
(5)一个晶胞中阳离子的个数为12×=3,阴离子个数为:8×=1,然后求出两者的个数之比为3:1;根据以Xn-为中心,在X、Y、Z三个轴上,在每个轴上等距离的C+有2个,共6个
(6)由于在NaCl晶体中,每个Na+周围同时吸引着最近的等距离的6个Cl-同样每个Cl-周围同时吸引着最近的等距离的6个Na+,图A符合条件,图D中选取其中一个离子,然后沿X、Y、Z三轴切割得到6个等距离的且最近的带相反电荷的离子,所以其配位数也是6,故符合条件,故答案为:AD.
点评:本题综合性较大,考查电离能、化学键与键能关系、常用化学用语书写、核外电子排布规律、晶胞结构与计算等,需要学生具备扎实的知识,难度中等,注意(6)中识记中学常见晶胞结构.

练习册系列答案
相关题目