摘要:(一)必考题 26.各物质之间的转换关系如下图.部分生成物省略. 相关信息如下 i.X为红褐色沉淀, ii.A为单质.B为溶液.D和F为气体, iii.反应②为某化工生产中的尾气处理方式.产物只有Y和H2O. 根据以上信息回答下列问题: (1)组成A的元素在周期表中属于: , 副族元素 短周期元素 (2)写出B物质的化学式: , (3)写出反应②的化学反应方程式: , (4)以石墨为两极材料.电解C的水溶液.写出电解初期阴极的电极反应式: , (5)28g单质A与一定浓度的B溶液反应.当生成n:2:3时发生转移 mol电子, (6)在仅含E的溶液中加入Na2O2生成X时.写出当n(E):n(Na2O2)=1:1时反应的离子方程式: . 27.兴趣小组的学生根据Mg与CO2反应原理推测钠也能在CO2中燃烧.为了确定其产物并进行实验论证.某同学设计了下列装置进行实验(已知PdCl2能被CO还原得到黑色的Pd.请回答下列问题: (1)上图装置2中应盛放 溶液. (2)为了使反应随开随用.随关随停.上图方框内应选用 装置. (3)检查装置的气密性完好并装好药品后.在点燃酒精灯前.应先进行1装置的操作.待装置 中出现 现象时.再点酒精 灯.这步操作的目的是 (4)①若装置6中有黑色沉淀生成.装置4中残留固体加盐酸后有能使澄清石灰水变浑浊的气体放出.则钠与二氧化碳反应的化学方程式为 . ②若装置6中溶液无明显现象.装置4中残留固体加盐酸后有能使澄清石灰水变浑浊的气体放出.则钠与二氧化碳反应的化学方程式为 . (5)指导老师认为.不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳.当确认钠充分反应后.请你设计一个简单实验.验证装置4中的残留固体中是否有Na2O和C: 28.火力发电厂释放出大量的氮氧化物(NOx).二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝.脱硫和脱碳等处理.可实现绿色环保.节能减排.废物利用等目的. (1)脱硝.利用甲烷催化还原NOx: CH4(g)+4NO2+CO2(g)+2H2O(g)△H1=-574 kJ·mol-1 CH4=2N2(g)+CO2(g)+2H2O(g)△H2=-1160 kJ·mol-1 甲烷直接将NO2还原为N2的热化学方程式为 . (2)脱碳.将CO2转化为甲醇的热化学方程式为: CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3 ①取五份等体积CO2和H2的混合气体(物质的量之比 均为1∶3).分别加入温度不同.容积相同的恒容密闭 容器中.发生上述反应.反应相同时间后.测得甲醇的 体积分数φ(CH3OH) 与反应温度T的关系曲线如右图 所示.则上述CO2转化为甲醇的反应的△H3 0. ②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2.进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如右下图所示.下列说法正确的是 . A.第10 min后.向该容器中再充入1 mol CO2和3 mol H2.则再次达到平 衡时c(CH3OH)=1.5 mol/L B.0~10 min内.氢气的平均反应速率 为0.075 mol/ C.达到平衡时.氢气的转化率为0.75 D.该温度下.反应的平衡常数的值为 3/16 E.升高温度将使n(CH3OH)/n(CO2)减小 ③直接甲醇燃料电池结构如右下图 所示.其工作时正极的电极反应式可表 示为 . (3)脱硫.某种脱硫工艺中将废气经处理后.与一定量的氨气.空气反应.生成硫酸铵和硝酸铵的混合物作为副产品化肥.硫酸铵和硝酸铵的水溶液的pH<7.其中原因可用一个离子方程式表示为: ,在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液.使溶液的pH=7.则溶液中c(Na+)+c(H+) c(NO3-)+c(OH-)(填写“> “= 或“< ) 35.[化学--物质结构与性质] 下表为长式周期表的一部分.其中的序号代表对应的元素. ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ (1)写出上表中元素⑨原子的外围电子排布式 . (2)在元素③与①形成的水果催熟剂气体化合物中.元素③的杂化方式为 杂化,元素⑦与⑧形成的化合物的晶体类型是 . (3)元素④的第一电离能 元素⑤(填写“> “= 或“< )的第一电离能,元素④与元素①形成的X分子的空间构型为 .请写出与元素④的单质互为等电子体分子.离子的化学式 . (4)在测定元素①与⑥形成化合物的相对分子质量时.实验测得的 值一般高于理论值的主要原因是 . (5)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反 应时.元素④被还原到最低价.该反应的化学方程式为 . (6)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中.反应的离子方程式为 ,元素⑩的某种氧化物的晶体结构如图所示.其中实心球表示元素⑩原子.则一个晶胞中所包含的氧原子数目为 . 36.[化学--有机化学基础]A为有机合成中间体.在一定条件下发生消去反应.可能得到两种互为同分异构体的产物.其中的一种B可用于制取合成树脂.染料等多种化工产品.A能发生如图所示的变化. 试回答: (1)写出符合下述条件A的同分异构体的结构简式: a.具有酸性.H-NMR谱图有3组峰________, b.能发生水解反应.H-NMR谱图有4组峰_________. (2)A分子中含氧官能团的名称是 .D结构简式是 . (3)写出化学方程式:A→B . (4)写出E生成高聚物的化学方程式: . (5)C的同分异构体C1与C有相同的官能团.两分子C1脱去两分子水形成含有六元环的C2.写出C1的结构简式: .
网址:http://m.1010jiajiao.com/timu3_id_433661[举报]
周期表中有六种元素,其中X的原子半径最小,Y、Z、G、J、M五种元素的位置如下所示,C、D是由X、Y、Z中两种元素组成的化合物,C通常状况下为无色液体,D为无色非可燃性气体,常温下G为有颜色的单质气体,各物质之间的转换关系如下图,部分生成物省略.N有漂白作用,反应①常用于制作印刷电路板.
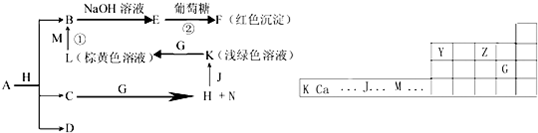
请回答下列问题:
(1)写出由四种元素组成的化合物A的化学式 ,C分子的电子式 .
(2)反应②在医学上有重要的应用,可用于检验病人尿液的葡萄糖是否存在,请写出反应②的化学方程式 .
(3)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体.请写出该反应的化学方程式: .
查看习题详情和答案>>

请回答下列问题:
(1)写出由四种元素组成的化合物A的化学式
(2)反应②在医学上有重要的应用,可用于检验病人尿液的葡萄糖是否存在,请写出反应②的化学方程式
(3)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体.请写出该反应的化学方程式:
甲、乙、丙均为中学化学常见的气体单质,A、B、C为常见的化合物,已知:A和B都极易溶于水,用两根玻璃棒分别蘸取A和B的浓溶液后,相互靠近会看到白烟各物质之间存在如图所示的转化关系
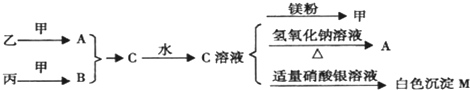
请回答下列问题:
(1)C溶液显 性(填“酸”、“碱”或“中”),若A溶液的物质的量浓度是B溶液的物质的量浓度的2倍,且等体积混合后溶液中各离子浓度由大到小的顺序为 (用离子符号表示).
(2)一定条件下,乙气体与甲气体充分反应生成6.8g A气体,可放出18.44KJ热量,则该反应的热化学方程式为
(3)在一定温度下,向容积不变(容积为10L)的密闭容器中加入2mol乙气体、8mol甲气体及固体催化剂.10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,用乙气体表示的反应速率为: ,反应达平衡犹态时甲气体的转化率为 ,若想提高A的产率,根据化学平衡移动原理,请提出合理的建议: (任意写一条);在上述平衡中,若再加入2molA气体、2mol乙气体,则此时化学平衡将 移动.(填“向正方向”、“向逆方向”或“不”).
(4)常温下,向含白色沉淀M的浊液中加入氯化钠固体,M的溶解度将 (填“增大“、“减小“或“不变”),Ksp(M)将 (填“增大“、“减小“或“不变”).
查看习题详情和答案>>

请回答下列问题:
(1)C溶液显
(2)一定条件下,乙气体与甲气体充分反应生成6.8g A气体,可放出18.44KJ热量,则该反应的热化学方程式为
(3)在一定温度下,向容积不变(容积为10L)的密闭容器中加入2mol乙气体、8mol甲气体及固体催化剂.10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,用乙气体表示的反应速率为:
(4)常温下,向含白色沉淀M的浊液中加入氯化钠固体,M的溶解度将
(2010?伊春模拟)如图表示各物质之间的转化关系.已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液.请按要求填空:

(1)写出B的电子式:
(2)生成E的电极为
(3)反应①的化学方程式是
(4)反应⑥的离子方程式是
查看习题详情和答案>>

(1)写出B的电子式:
Na+[ ]2-Na+
]2-Na+
 ]2-Na+
]2-Na+Na+[ ]2-Na+
]2-Na+
. ]2-Na+
]2-Na+(2)生成E的电极为
阳极
阳极
(“阴极”或“阳极”)写出该电极的电极反应式:Fe+2OH--2e-=Fe(OH)2
Fe+2OH--2e-=Fe(OH)2
,反应⑤的现象是白色物质迅速转变为灰绿色最终变为红褐色
白色物质迅速转变为灰绿色最终变为红褐色
.(3)反应①的化学方程式是
3Fe+4H2O
Fe3O4+4H2
| ||
3Fe+4H2O
Fe3O4+4H2
.
| ||
(4)反应⑥的离子方程式是
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.如图表示各物质之间的转化关系.已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液.

请按要求填空:
(1)写出B的电子式:
(2)反应⑤的现象是
(3)反应①的化学反应方程式是
(4)反应⑥的离子方程式是
查看习题详情和答案>>

请按要求填空:
(1)写出B的电子式:
Na+[ ]2-Na+
]2-Na+
 ]2-Na+
]2-Na+Na+[ ]2-Na+
]2-Na+
. ]2-Na+
]2-Na+(2)反应⑤的现象是
迅速由白色变成灰绿色最终变为红褐色
迅速由白色变成灰绿色最终变为红褐色
.(3)反应①的化学反应方程式是
3Fe+4H2O
Fe3O4+4H2
| ||
3Fe+4H2O
Fe3O4+4H2
,在实验室引发反应④的操作是
| ||
在铝热剂上加少量KClO3,插上镁条并将其点燃
在铝热剂上加少量KClO3,插上镁条并将其点燃
.(4)反应⑥的离子方程式是
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.各物质之间的转换关系如图,部分生成物省略.
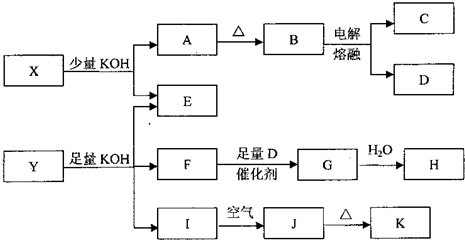
已知:①常温下,D、F、G为气体;C是日常生活中的常见金属;
②K的应用十分广泛,作为红色颜料跟某些油料混合,可以制成防锈油漆;
③E的水溶液中加盐酸无明显现象,然后加入BaCl2溶液出现浑浊.
请回答下列问题:
(1)写出F的电子式:
 ;
;
(2)写出化学式:X
(3)写出C与KOH液反应的化学方程式:
查看习题详情和答案>>

已知:①常温下,D、F、G为气体;C是日常生活中的常见金属;
②K的应用十分广泛,作为红色颜料跟某些油料混合,可以制成防锈油漆;
③E的水溶液中加盐酸无明显现象,然后加入BaCl2溶液出现浑浊.
请回答下列问题:
(1)写出F的电子式:


(2)写出化学式:X
Al2(SO4)3或KAl(SO4)2[或Kal(SO4)2?12H2O]
Al2(SO4)3或KAl(SO4)2[或Kal(SO4)2?12H2O]
、Y(NH4)2Fe(SO4)2[或(NH4)2Fe(SO4)2?6H2O]
(NH4)2Fe(SO4)2[或(NH4)2Fe(SO4)2?6H2O]
;(3)写出C与KOH液反应的化学方程式:
2Al+2KOH+2H2O=2KAlO2+3H2↑
2Al+2KOH+2H2O=2KAlO2+3H2↑
;写出H的稀溶液与I反应的离子方程式:3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O
3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O
.