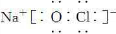题目内容
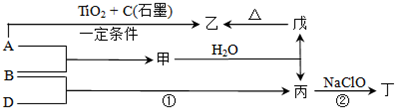
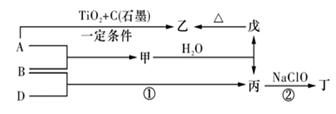
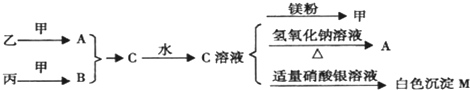
甲、乙、丙均为中学化学常见的气体单质,A、B、C为常见的化合物,已知:A和B都极易溶于水,用两根玻璃棒分别蘸取A和B的浓溶液后,相互靠近会看到白烟各物质之间存在如图所示的转化关系
请回答下列问题:
(1)C溶液显 性(填“酸”、“碱”或“中”),若A溶液的物质的量浓度是B溶液的物质的量浓度的2倍,且等体积混合后溶液中各离子浓度由大到小的顺序为 (用离子符号表示).
(2)一定条件下,乙气体与甲气体充分反应生成6.8g A气体,可放出18.44KJ热量,则该反应的热化学方程式为
(3)在一定温度下,向容积不变(容积为10L)的密闭容器中加入2mol乙气体、8mol甲气体及固体催化剂.10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,用乙气体表示的反应速率为: ,反应达平衡犹态时甲气体的转化率为 ,若想提高A的产率,根据化学平衡移动原理,请提出合理的建议: (任意写一条);在上述平衡中,若再加入2molA气体、2mol乙气体,则此时化学平衡将 移动.(填“向正方向”、“向逆方向”或“不”).
(4)常温下,向含白色沉淀M的浊液中加入氯化钠固体,M的溶解度将 (填“增大“、“减小“或“不变”),Ksp(M)将 (填“增大“、“减小“或“不变”).

请回答下列问题:
(1)C溶液显
(2)一定条件下,乙气体与甲气体充分反应生成6.8g A气体,可放出18.44KJ热量,则该反应的热化学方程式为
(3)在一定温度下,向容积不变(容积为10L)的密闭容器中加入2mol乙气体、8mol甲气体及固体催化剂.10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,用乙气体表示的反应速率为:
(4)常温下,向含白色沉淀M的浊液中加入氯化钠固体,M的溶解度将
分析:由A和B都极易溶于水,用两根玻璃棒分别蘸取A和B的浓溶液后,相互靠近会看到白,则A、B分别为氨气和HCl中的一种,所以C为NH4Cl,C与NaOH反应生成A,所以A为NH3,则B为HCl,结合转化关系可知,乙为N2,甲为H2,丙为Cl2,白色沉淀M为AgCl,然后结合物质的性质来解答.
解答:解:由A和B都极易溶于水,用两根玻璃棒分别蘸取A和B的浓溶液后,相互靠近会看到白,则A、B分别为氨气和HCl中的一种,所以C为NH4Cl,C与NaOH反应生成A,所以A为NH3,则B为HCl,结合转化关系可知,乙为N2,甲为H2,丙为Cl2,白色沉淀M为AgCl,
(1)氯化铵溶液中NH4+离子水解:NH4++H2O?NH3?H2O+H+,破坏睡得电离平衡,溶液呈酸性;
若NH3溶液的物质的量浓度是HCl溶液的物质的量浓度的2倍,且等体积混合后,为等浓度的NH4Cl、氨水混合溶液,氨水的电离程度大于NH4+离子水解程度,溶液呈碱性,故溶液中各离子浓度由大到小的顺序为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:酸;c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(2)一定条件下,N2与H2气体充分反应生成6.8g NH3气体,可放出18.44KJ热量,则生成2molNH3放出的热量为18.44kJ×
=92.2kJ,则该反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol;
(3)在一定温度下,向容积不变(容积为10L)的密闭容器中加入2molN2气体、8molH2气体及固体催化剂.10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,则平衡后混合气体总物质的量=(2mol+8mol)×80%=8mol,则:
N2(g)+3H2(g)?2NH3(g)△n
1 3 2 2
1mol 3mol 10mol-8mol=2mol
故氮气气体表示的反应速率为:
=0.01mol/(L.min),
反应达平衡状态时氢气的转化率为:
×100%=37.5%,
若想提高A的产率,根据化学平衡移动原理,应使平衡向正反应方向移动,可以增大氮气或氢气的浓度或及时移走氨气等,
N2(g)+3H2(g)?2NH3(g)
开始(mol):2 8 0
变化(mol):1 3 2
平衡(mol):1 5 2
故该温度下k=
=3.2,在上述平衡中,若再加入2molNH3气体、2molN2气体,则此时Qc=
=10.8,大于平衡常数3.2,故平衡向逆反应方向移动,
故答案为:0.01mol/(L.min);37.5%;增大氮气或氢气的浓度或及时移走氨气等;向逆方向;
(4)由AgCl(s)?Ag+(aq)+Cl-(aq)可知,加入氯化钠固体,溶解平衡逆向移动,AgCl的溶解度将减小,而温度不变,则Ksp(AgCl)不变,
故答案为:减小;不变.
(1)氯化铵溶液中NH4+离子水解:NH4++H2O?NH3?H2O+H+,破坏睡得电离平衡,溶液呈酸性;
若NH3溶液的物质的量浓度是HCl溶液的物质的量浓度的2倍,且等体积混合后,为等浓度的NH4Cl、氨水混合溶液,氨水的电离程度大于NH4+离子水解程度,溶液呈碱性,故溶液中各离子浓度由大到小的顺序为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:酸;c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(2)一定条件下,N2与H2气体充分反应生成6.8g NH3气体,可放出18.44KJ热量,则生成2molNH3放出的热量为18.44kJ×
| 2mol×17g/mol |
| 6.8g |
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol;
(3)在一定温度下,向容积不变(容积为10L)的密闭容器中加入2molN2气体、8molH2气体及固体催化剂.10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,则平衡后混合气体总物质的量=(2mol+8mol)×80%=8mol,则:
N2(g)+3H2(g)?2NH3(g)△n
1 3 2 2
1mol 3mol 10mol-8mol=2mol
故氮气气体表示的反应速率为:
| ||
| 10min |
反应达平衡状态时氢气的转化率为:
| 3mol |
| 8mol |
若想提高A的产率,根据化学平衡移动原理,应使平衡向正反应方向移动,可以增大氮气或氢气的浓度或及时移走氨气等,
N2(g)+3H2(g)?2NH3(g)
开始(mol):2 8 0
变化(mol):1 3 2
平衡(mol):1 5 2
故该温度下k=
(
| ||||
|
(
| ||||
|
故答案为:0.01mol/(L.min);37.5%;增大氮气或氢气的浓度或及时移走氨气等;向逆方向;
(4)由AgCl(s)?Ag+(aq)+Cl-(aq)可知,加入氯化钠固体,溶解平衡逆向移动,AgCl的溶解度将减小,而温度不变,则Ksp(AgCl)不变,
故答案为:减小;不变.
点评:本题考查无机物的推断,注意白烟为解答本题的突破口,熟悉铵盐的生成及氨气的制法即可解答,(3)中注意根据浓度商与平衡常数判断平衡移动方向,注重基本知识的考查,题目难度中等.

练习册系列答案
相关题目