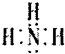题目内容
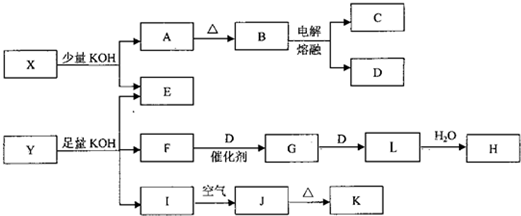
各物质之间的转换关系如图,部分生成物省略.
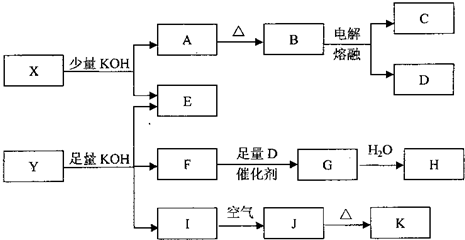
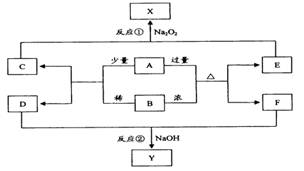
已知:①常温下,D、F、G为气体;C是日常生活中的常见金属;
②K的应用十分广泛,作为红色颜料跟某些油料混合,可以制成防锈油漆;
③E的水溶液中加盐酸无明显现象,然后加入BaCl2溶液出现浑浊.
请回答下列问题:
(1)写出F的电子式: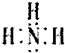
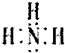 ;
;
(2)写出化学式:X
(3)写出C与KOH液反应的化学方程式:

已知:①常温下,D、F、G为气体;C是日常生活中的常见金属;
②K的应用十分广泛,作为红色颜料跟某些油料混合,可以制成防锈油漆;
③E的水溶液中加盐酸无明显现象,然后加入BaCl2溶液出现浑浊.
请回答下列问题:
(1)写出F的电子式:
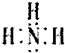
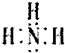
(2)写出化学式:X
Al2(SO4)3或KAl(SO4)2[或Kal(SO4)2?12H2O]
Al2(SO4)3或KAl(SO4)2[或Kal(SO4)2?12H2O]
、Y(NH4)2Fe(SO4)2[或(NH4)2Fe(SO4)2?6H2O]
(NH4)2Fe(SO4)2[或(NH4)2Fe(SO4)2?6H2O]
;(3)写出C与KOH液反应的化学方程式:
2Al+2KOH+2H2O=2KAlO2+3H2↑
2Al+2KOH+2H2O=2KAlO2+3H2↑
;写出H的稀溶液与I反应的离子方程式:3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O
3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O
.分析:电解B可得常见金属单质C和气体单质D,应为电解熔融的氧化铝的反应,则B为Al2O3,C为Al,D为O2,说明X中含有Al元素,E的水溶液中加盐酸无明显现象,然后加入BaCl2溶液出现浑浊,生成沉淀BaSO4,说明X中含有SO42-,所以X可能为Al2(SO4)3 或KAl(SO4)2[或Kal(SO4)2?12H2O],
K的应用十分广泛,作为红色颜料跟某些油料混合,可以制成防锈油漆,K应为Fe2O3,则J为Fe(OH)3,I为Fe(OH)2,说明Y中含有Fe2+,Y可KOH反应生成气体,该气体应为NH3,催化氧化可生成NO,最终生成HNO3,则F为NH3,G为NO,H为HNO3,说明Y中含有NH4+,E的水溶液中加盐酸无明显现象,然后加入BaCl2溶液出现浑浊,生成沉淀BaSO4,说明YX中含有SO42-,则Y可能为(NH4)2Fe(SO4)2[或(NH4)2Fe(SO4)2?6H2O],结合物质的性质、结构解答该题.
K的应用十分广泛,作为红色颜料跟某些油料混合,可以制成防锈油漆,K应为Fe2O3,则J为Fe(OH)3,I为Fe(OH)2,说明Y中含有Fe2+,Y可KOH反应生成气体,该气体应为NH3,催化氧化可生成NO,最终生成HNO3,则F为NH3,G为NO,H为HNO3,说明Y中含有NH4+,E的水溶液中加盐酸无明显现象,然后加入BaCl2溶液出现浑浊,生成沉淀BaSO4,说明YX中含有SO42-,则Y可能为(NH4)2Fe(SO4)2[或(NH4)2Fe(SO4)2?6H2O],结合物质的性质、结构解答该题.
解答:解:电解B可得常见金属单质C和气体单质D,应为电解熔融的氧化铝的反应,则B为Al2O3,C为Al,D为O2,说明X中含有Al元素,E的水溶液中加盐酸无明显现象,然后加入BaCl2溶液出现浑浊,生成沉淀BaSO4,说明X中含有SO42-,所以X可能为Al2(SO4)3 或KAl(SO4)2[或Kal(SO4)2?12H2O],
K的应用十分广泛,作为红色颜料跟某些油料混合,可以制成防锈油漆,K应为Fe2O3,则J为Fe(OH)3,I为Fe(OH)2,说明Y中含有Fe2+,Y可KOH反应生成气体,该气体应为NH3,催化氧化可生成NO,最终生成HNO3,则F为NH3,G为NO,H为HNO3,说明Y中含有NH4+,E的水溶液中加盐酸无明显现象,然后加入BaCl2溶液出现浑浊,生成沉淀BaSO4,说明YX中含有SO42-,则Y可能为(NH4)2Fe(SO4)2[或(NH4)2Fe(SO4)2?6H2O],
(1)F为NH3,电子式为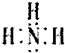 ,故答案为:
,故答案为: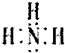 ;
;
(2)由以上分析可知,X可能为Al2(SO4)3 或KAl(SO4)2[或Kal(SO4)2?12H2O],Y可能为(NH4)2Fe(SO4)2[或(NH4)2Fe(SO4)2?6H2O],
故答案为:Al2(SO4)3 或KAl(SO4)2[或Kal(SO4)2?12H2O];(NH4)2Fe(SO4)2[或(NH4)2Fe(SO4)2?6H2O];
(3)C为Al,与KOH溶液反应生成KAlO2和H2,反应的离子方程式为2Al+2KOH+2H2O=2KAlO2+3H2↑,H为HNO3,具有强氧化性,I为Fe(OH)2,具有还原性,二者发生氧化还原反应生成Fe3+和NO,反应的离子方程式为3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O,
故答案为:2Al+2KOH+2H2O=2KAlO2+3H2↑;3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O.
K的应用十分广泛,作为红色颜料跟某些油料混合,可以制成防锈油漆,K应为Fe2O3,则J为Fe(OH)3,I为Fe(OH)2,说明Y中含有Fe2+,Y可KOH反应生成气体,该气体应为NH3,催化氧化可生成NO,最终生成HNO3,则F为NH3,G为NO,H为HNO3,说明Y中含有NH4+,E的水溶液中加盐酸无明显现象,然后加入BaCl2溶液出现浑浊,生成沉淀BaSO4,说明YX中含有SO42-,则Y可能为(NH4)2Fe(SO4)2[或(NH4)2Fe(SO4)2?6H2O],
(1)F为NH3,电子式为
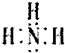 ,故答案为:
,故答案为: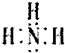 ;
;(2)由以上分析可知,X可能为Al2(SO4)3 或KAl(SO4)2[或Kal(SO4)2?12H2O],Y可能为(NH4)2Fe(SO4)2[或(NH4)2Fe(SO4)2?6H2O],
故答案为:Al2(SO4)3 或KAl(SO4)2[或Kal(SO4)2?12H2O];(NH4)2Fe(SO4)2[或(NH4)2Fe(SO4)2?6H2O];
(3)C为Al,与KOH溶液反应生成KAlO2和H2,反应的离子方程式为2Al+2KOH+2H2O=2KAlO2+3H2↑,H为HNO3,具有强氧化性,I为Fe(OH)2,具有还原性,二者发生氧化还原反应生成Fe3+和NO,反应的离子方程式为3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O,
故答案为:2Al+2KOH+2H2O=2KAlO2+3H2↑;3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O.
点评:本题考查无机物的推断,题目难度较大,本题注意根据物质反应的化学现象采用正推和逆推相结合的方法推断,学习中牢固把握相关基础知识,此类题目可轻松解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目