题目内容
科学家一直致力于“人工固氨”的新方法研究.目前合成氨技术原理为:
N2(g)+3H2(g)?2NH3(g)+92.4kJ/mol
673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图1所示.
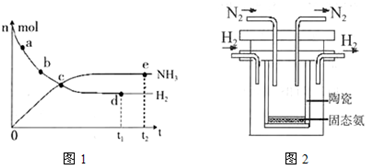
(1)下列叙述正确的是
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的n (N2)相同
D.773K,30MPa 下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)在容积为2.0L恒容得密闭容器中充入0.80mol N2(g)和1.60mol H2(g),673K、30MPa下达到平衡时,NH3的体积分数为20%.该条件下,N2(g)+3H2(g)?2NH3(g)的平衡常数值为:
(3)K值越大,表明反应达到平衡时
A.H2的转化率一定越高 B.NH3的产量一定越大 C.正反应进行得越完全 D.化学反应速率越大
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电解合成氨.其实验装置如图2.阳极的电极反应为:H2-2e→2H+,则阴极的电极反应为:
N2(g)+3H2(g)?2NH3(g)+92.4kJ/mol
673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图1所示.

(1)下列叙述正确的是
AC
AC
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的n (N2)相同
D.773K,30MPa 下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)在容积为2.0L恒容得密闭容器中充入0.80mol N2(g)和1.60mol H2(g),673K、30MPa下达到平衡时,NH3的体积分数为20%.该条件下,N2(g)+3H2(g)?2NH3(g)的平衡常数值为:
1.07
1.07
.(3)K值越大,表明反应达到平衡时
C
C
.A.H2的转化率一定越高 B.NH3的产量一定越大 C.正反应进行得越完全 D.化学反应速率越大
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电解合成氨.其实验装置如图2.阳极的电极反应为:H2-2e→2H+,则阴极的电极反应为:
N2+6H++6e-=2NH3
N2+6H++6e-=2NH3
.分析:(1)A.浓度越大反应速率越快;
B.a、b、c之后氢气的物质的量继续变化,未达到平衡,反应向正反进行;
C.d、e对应氢气、氨气的物质的量不变,处于平衡状态;
D.该反应正反应是放热反应,温度升高平衡向逆反应移动;
(2)令转化的氮气的物质的量为ymol,利用三段式表示出平衡时各组分的物质的量,根据氨气的体积分数列方程计算y的值,计算平衡浓度,倒入平衡常数表达式计算;
(3)K值越大,表示反应进行程度大,但该温度下不一定反应发生,氢气的转化率与氮气、氢气的投入量等有关,转化率不一定高,氨气的产率与与氮气、氢气的投入量等有关,产量不一定大;
(4)电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,酸性条件下生成氨气.
B.a、b、c之后氢气的物质的量继续变化,未达到平衡,反应向正反进行;
C.d、e对应氢气、氨气的物质的量不变,处于平衡状态;
D.该反应正反应是放热反应,温度升高平衡向逆反应移动;
(2)令转化的氮气的物质的量为ymol,利用三段式表示出平衡时各组分的物质的量,根据氨气的体积分数列方程计算y的值,计算平衡浓度,倒入平衡常数表达式计算;
(3)K值越大,表示反应进行程度大,但该温度下不一定反应发生,氢气的转化率与氮气、氢气的投入量等有关,转化率不一定高,氨气的产率与与氮气、氢气的投入量等有关,产量不一定大;
(4)电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,酸性条件下生成氨气.
解答:解:(1)A.a点反应物的浓度大于b点,浓度越大反应速率越快,故a点反应速率更大,故A正确;
B.点c之后氢气的物质的量继续减小,未达到平衡,反应向正反进行,故B错误;
C.d、e对应氢气、氨气的物质的量不变,处于平衡状态,点d和点e处的n (N2)相同,故C正确;
D.该反应正反应是放热反应,温度升高平衡向逆反应移动,氨气的物质的量减小,故D错误;
故选AC;
(2)令平衡时转化的氮气的物质的量为ymol,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):0.8 1.6 0
变化(mol):x 3x 2x
平衡(mol):0.8-x 1.6-3x 2x
故
=20%,解得x=0.2,
故 N2、H2、NH3的平衡浓度分别为
=0.3mol/L、
=0.5mol/L、
=0.2mol/L
故该温度下平衡常数k=
=1.07,
故答案为:1.07;
(3)A.氢气的转化率与氮气、氢气的投入量等有关,K值大,氢气转化率不一定高,故A错误;
B.氨气的产率与与氮气、氢气的投入量等有关,K值大,氨气的产量不一定大,故B错误;
C.K值越大,表示反应进行程度大,即正反应进行得越完全,故C正确;
D.K值越大,表示反应进行程度大,但该温度下不一定反应发生,反应速率不一定大,故D错误;
故选C;
(4)电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,所以阴极反应为:N2+6H++6e-=2NH3,
故答案为:N2+6H++6e-=2NH3.
B.点c之后氢气的物质的量继续减小,未达到平衡,反应向正反进行,故B错误;
C.d、e对应氢气、氨气的物质的量不变,处于平衡状态,点d和点e处的n (N2)相同,故C正确;
D.该反应正反应是放热反应,温度升高平衡向逆反应移动,氨气的物质的量减小,故D错误;
故选AC;
(2)令平衡时转化的氮气的物质的量为ymol,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):0.8 1.6 0
变化(mol):x 3x 2x
平衡(mol):0.8-x 1.6-3x 2x
故
| 2x |
| 0.8-x+1.6-3x+2x |
故 N2、H2、NH3的平衡浓度分别为
| 0.8mol-0.2mol |
| 2L |
| 1.6mol-3×0.2mol |
| 2L |
| 2×0.2mol |
| 2L |
故该温度下平衡常数k=
| 0.22 |
| 0.3×0.53 |
故答案为:1.07;
(3)A.氢气的转化率与氮气、氢气的投入量等有关,K值大,氢气转化率不一定高,故A错误;
B.氨气的产率与与氮气、氢气的投入量等有关,K值大,氨气的产量不一定大,故B错误;
C.K值越大,表示反应进行程度大,即正反应进行得越完全,故C正确;
D.K值越大,表示反应进行程度大,但该温度下不一定反应发生,反应速率不一定大,故D错误;
故选C;
(4)电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,所以阴极反应为:N2+6H++6e-=2NH3,
故答案为:N2+6H++6e-=2NH3.
点评:本题考查化学平衡图象、化学平衡常数计算与意义、电解原理等,难度不大,注意理解平衡常数的意义.

练习册系列答案
相关题目


 。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算
。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算  的平衡常数。
的平衡常数。