题目内容
科学家一直致力于“人工固氮”的新方法研究.最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂表面与水发生下列反应:
2N2(g)+6H2O(l) 4NH3 (g)+3O2(g)△H=a kJ?mol-1
4NH3 (g)+3O2(g)△H=a kJ?mol-1
上述反应NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
(1)此合成反应的a
(2)用水稀释0.1mol?L-1氨水,溶液中随着水量的增加而减小的是
A.
B.
C.c(H+)?c(OH-) D.
(3)氨可用于工业制硝酸,其主反应为:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H<0
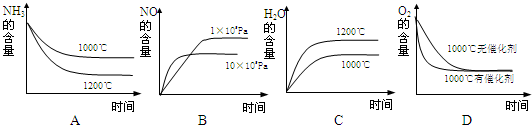
若此反应起始的物质的量相同,则下列关系图正确的是
(4)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
①反应在第2min到第4min时,O2 的平均反应速率为
②反应在第2min到第4min时改变了条件,改变的条件可能是
③在第6min到第8min时,改变了反应的条件,该平衡向
2N2(g)+6H2O(l)
 4NH3 (g)+3O2(g)△H=a kJ?mol-1
4NH3 (g)+3O2(g)△H=a kJ?mol-1上述反应NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
>
>
0 (填“>”“<”或“=”)(2)用水稀释0.1mol?L-1氨水,溶液中随着水量的增加而减小的是
AD
AD
(填字母标号)A.
| c(NH3?H2O) |
| c(OH-) |
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| c(OH-) |
| c(H+) |
(3)氨可用于工业制硝酸,其主反应为:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H<0
若此反应起始的物质的量相同,则下列关系图正确的是
BD
BD
(填序号)
(4)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8000 | 1.600 | 0.000 |
| 第2min | 0.6000 | a | 0.2000 |
| 第4min | 0.3000 | 0.9750 | 0.5000 |
| 第6min | 0.3000 | 0.9750 | 0.5000 |
| 第8min | 0.7000 | 1.475 | 0.1000 |
0.1875
0.1875
mol/(L?min)②反应在第2min到第4min时改变了条件,改变的条件可能是
升高温度或使用催化剂
升高温度或使用催化剂
.③在第6min到第8min时,改变了反应的条件,该平衡向
左
左
移动(填“左”或“右”).分析:(1)根据温度对化学平衡的影响分析;
(2)根据电离平衡常数、溶液中各微粒的浓度分析;
(3)根据温度、压强对化学平衡的影响分析;
(4)①先根据v=
计算氨气的平均化学反应速率,再根据同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比计算氧气的平均化学反应速率;
②先分析图表,再根据外界对化学平衡的影响分析;
③根据物质的浓度变化判断反应方向.
(2)根据电离平衡常数、溶液中各微粒的浓度分析;
(3)根据温度、压强对化学平衡的影响分析;
(4)①先根据v=
| △C |
| △t |
②先分析图表,再根据外界对化学平衡的影响分析;
③根据物质的浓度变化判断反应方向.
解答:解:(1)通过图表知,升高温度,生成物的物质的量增加,平衡向正反应方向移动,所以正反应方向是吸热方向,△H>0,所以a>0,
故答案为:>;
(2)A、当稀释氨水时,在水分子的作用下促进氨水的电离,所以氨根离子的浓度降低,
=K电离,温度不变,电离平衡常数不变,所以
减小,故A正确;
B、该式子是电离平衡常数表达式,温度不变,电离平衡常数不变,故B错误;
C、温度不变,水的离子积不变,故C错误;
D、温度不变,水的离子积不变,当稀释氨水时,溶液中氢氧根的浓度减小,氢离子的浓度增加,所以
减小,故D正确;
故答案为:AD;
(3)A、该反应是放热反应,升高温度,平衡向逆反应方向移动,所以氨气的转化率减小,氨气的含量增大,故A错误;
B、该反应是气体体积增大的反应,增大压强平衡向气体体积减小的方向移动,即正反应方向移动,所以NO的含量增大,故B正确;
C、该反应是放热反应,升高温度,平衡向逆反应方向移动,所以水的含量减小,故C错误;
D、催化剂只改变反应到达平衡的时间,对化学平衡无影响,故D正确.
故答案为:BD;
(4)①氨气的平均化学反应速率为v=
=
=0.015 mol/L.min,同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,所以氧气的平均化学反应速率为0.1875mol/L.min.
故答案为:0.1875;
②通过图表比较起始到第2min和第2min到第4min时知,反应物和生成物的反应速率都增大,所以改变的条件是升高温度或使用催化剂.
故答案为:升高温度(或使用催化剂);
③通过图表知,反应物浓度增大,生成物浓度减小,所以平衡向逆反应方向移动,即向左移动.故答案为:左.
故答案为:>;
(2)A、当稀释氨水时,在水分子的作用下促进氨水的电离,所以氨根离子的浓度降低,
| C(NH4 +)C(OH-) |
| C(NH3.H2O) |
| C(NH3.H2O) |
| C(OH-) |
B、该式子是电离平衡常数表达式,温度不变,电离平衡常数不变,故B错误;
C、温度不变,水的离子积不变,故C错误;
D、温度不变,水的离子积不变,当稀释氨水时,溶液中氢氧根的浓度减小,氢离子的浓度增加,所以
| C(OH-) |
| C(H+) |
故答案为:AD;
(3)A、该反应是放热反应,升高温度,平衡向逆反应方向移动,所以氨气的转化率减小,氨气的含量增大,故A错误;
B、该反应是气体体积增大的反应,增大压强平衡向气体体积减小的方向移动,即正反应方向移动,所以NO的含量增大,故B正确;
C、该反应是放热反应,升高温度,平衡向逆反应方向移动,所以水的含量减小,故C错误;
D、催化剂只改变反应到达平衡的时间,对化学平衡无影响,故D正确.
故答案为:BD;
(4)①氨气的平均化学反应速率为v=
| △C |
| △t |
| (0.6000-0.3000)mol/L |
| 2min |
故答案为:0.1875;
②通过图表比较起始到第2min和第2min到第4min时知,反应物和生成物的反应速率都增大,所以改变的条件是升高温度或使用催化剂.
故答案为:升高温度(或使用催化剂);
③通过图表知,反应物浓度增大,生成物浓度减小,所以平衡向逆反应方向移动,即向左移动.故答案为:左.
点评:本题考查了化学平衡的影响因素,难度不大,易错题是(2)题,注意稀释溶液时各微粒浓度的变化,平衡常数只与温度有关,与物质的浓度无关.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


 。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算
。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算  的平衡常数。
的平衡常数。