题目内容
科学家一直致力于“人工固氮”的新方法研究.据报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3和O2.
(1)已知:①H2(g)+
O2(g)═H2O(l)△Hl=-285.6kJ/mol
②N2(g)+3H2(g)?2NH3(g)△H2=-92.2kJ/mol
写出此条件下氮气和水反应的热化学方程式 .
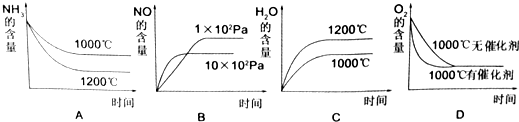
(2)氨可用于工业制硝酸,其主反应为:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,此反应的化学平衡常数表达式为 ,若此反应起始的物质的量相同,则如图所示的关系图正确的是 (填序号)
在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
①反应在第2min到第4min时,O2的平均反应速率为 mol?L-1?min-1.
②反应在第2min时改变了条件,改变的条件可能是 .
③在第6min时,改变了反应的条件,该平衡向 移动(填“左”或“右”).
(1)已知:①H2(g)+
| 1 |
| 2 |
②N2(g)+3H2(g)?2NH3(g)△H2=-92.2kJ/mol
写出此条件下氮气和水反应的热化学方程式
(2)氨可用于工业制硝酸,其主反应为:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,此反应的化学平衡常数表达式为

在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
| 起始 | 0.8000 | 1.600 | 0.000 |
| 第2min | 0.6000 | a | 0.2000 |
| 第4min | 0.3000 | 0.9750 | 0.5000 |
| 第6min | 0.3000 | 0.9750 | 0.5000 |
| 第8min | 0.7000 | 1.475 | 0.1000 |
②反应在第2min时改变了条件,改变的条件可能是
③在第6min时,改变了反应的条件,该平衡向
分析:(1)根据盖斯定律计算求出△H;
(2)根据化学方程式写出平衡常数表达式;根据影响平衡的因素分析;
①根据参加反应的氨气的量求出氧气的量,然后求出反应速率;
②容积固定的密闭容器,因此改变压强无影响,有速率变快,所以是升高温度或加了催化剂;
③在第6min时,反应物增加说明平衡向逆方向移动.
(2)根据化学方程式写出平衡常数表达式;根据影响平衡的因素分析;
①根据参加反应的氨气的量求出氧气的量,然后求出反应速率;
②容积固定的密闭容器,因此改变压强无影响,有速率变快,所以是升高温度或加了催化剂;
③在第6min时,反应物增加说明平衡向逆方向移动.
解答:解:(1)先根据反应物和生成物写出方程2N2(g)+6H2O(l)=4NH3(g)+3O2(g),在根据目标方程改写分方程,方程①×6再反写,与方程②×2相加,
所以△H=△H2-6△Hl═-92.2×2+285.6×6=1529.22kJ/mol;故答案为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1529.2kJ/mol;
(2)根据化学方程式写出平衡常数表达式K=
;故答案为:
;
A、反应的△H<0,升高温度平衡逆移,氨气浓度增大,故1200℃的曲线应在上面,故A错误;
B、该反应正方向为计量数增大的方向,所以增大压强平衡逆移,NO的含量减少,故B正确;
C、升高温度平衡逆移,水的含量减小,故C错误;
D、加催化剂平衡不移动,反应速率加快,故D正确;
故答案为:B、D;
①第2min到第4min,参加反应的氨气为c(NH3)=0.6-0.3=0.3mol?L-1参加反应的氧气为:c(O2)=
×0.3mol?L-1=0.24mol?L-1
v(O2)=
=0.1875 mol?L-1?min-1,故答案为:0.1875;
②容积固定的密闭容器,因此改变压强无影响,因为速率变快,所以是升高温度或加了催化剂,故答案为:升高温度或使用催化剂;
③在第6min时,反应物增加说明平衡向逆方向移动,故答案为:左.
所以△H=△H2-6△Hl═-92.2×2+285.6×6=1529.22kJ/mol;故答案为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1529.2kJ/mol;
(2)根据化学方程式写出平衡常数表达式K=
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |
A、反应的△H<0,升高温度平衡逆移,氨气浓度增大,故1200℃的曲线应在上面,故A错误;
B、该反应正方向为计量数增大的方向,所以增大压强平衡逆移,NO的含量减少,故B正确;
C、升高温度平衡逆移,水的含量减小,故C错误;
D、加催化剂平衡不移动,反应速率加快,故D正确;
故答案为:B、D;
①第2min到第4min,参加反应的氨气为c(NH3)=0.6-0.3=0.3mol?L-1参加反应的氧气为:c(O2)=
| 5 |
| 4 |
v(O2)=
| c(O2) |
| t |
②容积固定的密闭容器,因此改变压强无影响,因为速率变快,所以是升高温度或加了催化剂,故答案为:升高温度或使用催化剂;
③在第6min时,反应物增加说明平衡向逆方向移动,故答案为:左.
点评:本题考查了利用盖斯定律求算反应热,化学平衡移动,平衡常数,反应速率的计算,综合性较强.

练习册系列答案
相关题目


 。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算
。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算  的平衡常数。
的平衡常数。