摘要: 已知A.B.C.D.E是短周期中原子序数依次增大的5种主族元素.其中元素A.E的单质在常温下呈气态.元素B的原子最外层电子数是其电子层数的2倍.元素C在同周期的主族元素中原子半径最大.元素D的合金是日常生活中常用的金属材料.下列说法正确的是 A.元素A.B组成的化合物常温下一定呈气态 B.一定条件下.元素C.D的最高价氧化物对应的水化物之间不能发生反应 C.化合物AE与CE古有相同类型的化学键ww.k@s@5@ 高#考#资#源#网 D.工业上常用电解法制备元素C.D.E的单质
网址:http://m.1010jiajiao.com/timu3_id_432878[举报]
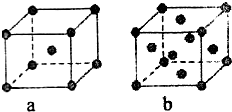 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.请回答下列问题:
(1)B、C、D的电负性由小到大的顺序为
(2)A的常见气态氢化物和D的气态氢化物相遇会剧烈反应生成化合物甲,则甲中含有的化学键有
(3)E原子的基态电子排布式为
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D元素是地壳中含量最多的元素.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D元素是地壳中含量最多的元素.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的基态原子的外围电子排布式为
3d24s2
3d24s2
.(2)由A、B、C形成的ABC分子中,含有
2
2
个σ键,2
2
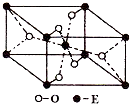
个π键;(3)E的一种氧化物Q,其晶胞结构如图所示,则Q的化学式为
TiO2
TiO2
,该晶体中氧原子的配位数为3
3
.(4)B、C、D三种元素的第一电离能由小到大的顺序为
C<O<N
C<O<N
.(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl3?6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配离子的化学式为
[TiCl(H2O)5]2+
[TiCl(H2O)5]2+
.已知A、B、C、D、E均为短周期元素,它们的原子序数依次递增.A单质是自然界中密度最小的气体,C元素原子的最外层电子数是次外层的3倍,D原子的最内层电子数和最外层电子数之和等于其次外层电子数,E单质性质活泼;B和C可形成多种气态化合物.A、B、C三种元素可以形成离子化合物甲,甲是一种常见的化肥,甲可以和氢氧化钠反应放出无色刺激性气味气体乙,乙能使湿润的红色石蕊试纸变蓝.请回答下列问题:
(1)写出C元素在周期表中的位置
(2)写出B单质分子的电子式
 ;乙分子的结构式
;乙分子的结构式
 .
.
(3)化肥甲的俗称是
(4)元素D与元素E相比,非金属性较强的是
(5)往甲的浓溶液中加入NaOH的浓溶液并加热,反应的离子方程式是
查看习题详情和答案>>
(1)写出C元素在周期表中的位置
第二周期ⅥA族
第二周期ⅥA族
.(2)写出B单质分子的电子式




(3)化肥甲的俗称是
硝铵
硝铵
;甲晶体中含有的化学键类型有离子键、共价键
离子键、共价键
.(4)元素D与元素E相比,非金属性较强的是
Cl
Cl
(用元素符号表示),请例举能证明这一结论的两个事实氯化氢比硫化氢稳定
氯化氢比硫化氢稳定
、高氯酸酸性比硫酸强
高氯酸酸性比硫酸强
.(5)往甲的浓溶液中加入NaOH的浓溶液并加热,反应的离子方程式是
NH4++OH-
NH3↑+H2O
| ||
NH4++OH-
NH3↑+H2O
.
| ||
 已知A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A和B可形成常见化合物BA4,一个BA4分子中电子总数为10;C原子的最外层电子数是核外电子总数的
已知A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A和B可形成常见化合物BA4,一个BA4分子中电子总数为10;C原子的最外层电子数是核外电子总数的| 3 |
| 4 |
(1)D与E两元素相比较,非金属性较强的是
氯
氯
(填元素名称),请你自选试剂设计实验验证该结论(说明试剂、简单操作、实验现象)将Cl2通入Na2S溶液(或氢硫酸)中,有浅黄色沉淀生成,说明Cl的非金属性比S强
将Cl2通入Na2S溶液(或氢硫酸)中,有浅黄色沉淀生成,说明Cl的非金属性比S强
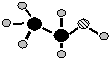
;(2)由A、B、C三种元素组成的化合物的球棍结构如图所示,试写出利用植物秸秆生产这种物质的化学方程式
(C6H10O5)n+nH2O
nC6H12O6
| 催化剂 |
| △ |
(C6H10O5)n+nH2O
nC6H12O6
、| 催化剂 |
| △ |
C6H12O6
2CH3CH2OH+2CO2↑
| 一定条件 |
C6H12O6
2CH3CH2OH+2CO2↑
.| 一定条件 |
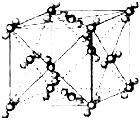 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如图所示.E的电负性在该周期中最大.镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如图所示.E的电负性在该周期中最大.镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.试回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)基态Ga原子的核外电子排布式为
(2)A、B、C的第一电离能由大到小的顺序为
(3)B元素的单质分子中有
(4)上述A的氧化物分子中心原子采取
(5)FH3沸点与比BH3
(6)固体CrE3?6H2O溶于水可能有几种不同组成的配离子,实验将含0.2665gCrE3?6H2O的溶液通过H-离子交换树脂(只交换配阳离子),交换出的酸用0.125mol/L的氢氧化钠溶液8.00mL中和.已知配离子配位数为6,则该配离子是