题目内容
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D元素是地壳中含量最多的元素.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D元素是地壳中含量最多的元素.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的基态原子的外围电子排布式为
3d24s2
3d24s2
.(2)由A、B、C形成的ABC分子中,含有
2
2
个σ键,2
2
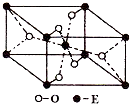
个π键;(3)E的一种氧化物Q,其晶胞结构如图所示,则Q的化学式为
TiO2
TiO2
,该晶体中氧原子的配位数为3
3
.(4)B、C、D三种元素的第一电离能由小到大的顺序为
C<O<N
C<O<N
.(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl3?6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配离子的化学式为
[TiCl(H2O)5]2+
[TiCl(H2O)5]2+
.分析:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同,短周期s区,只有ⅠA有单电子,则A为氢元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B原子电子排布式为1s22s22p2,故B为碳元素;D元素是地壳中含量最多的元素,则D为O元素,所以C为N元素;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,则E的原子序数为18+4=22,为Ti元素,然后结合原子结构与性质、化学用语等来解答.
解答:解:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同,短周期s区,只有ⅠA有单电子,则A为氢元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B原子电子排布式为1s22s22p2,故B为碳元素;D元素是地壳中含量最多的元素,则D为O元素,所以C为N元素;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,则E的原子序数为18+4=22,为Ti元素,
(1)E为Ti,原子序数为22,其基态原子的外围电子排布式为3d24s2,故答案为:3d24s2;
(2)A、B、C形成的ABC分子为HCN,结构为H-C≡N,则含2个σ键,2个π键,故答案为:2;2;
(3)由晶胞结构可知,晶胞中Ti元素数目为1+8×
=2,O原子数目为2+4×
=4,故该氧化物的化学式为TiO2,由晶胞结构可知,每个O原子周围有3个Ti原子,氧的配位数为3,故答案为:TiO2;3;
(4)同周期自左而右第一电离能增大,但N原子p轨道半满,为稳定状态,故第一电离能C<O<N,故答案为:C<O<N;
(5)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3?6H20的绿色晶体,该晶体中两配体的物质的量之比为1:5,则配体中有1个Cl-、5个H2O,2个氯离子位于外界,则该配离子的化学式为[TiCl(H2O)5]2+,故答案为:[TiCl(H2O)5]2+.
(1)E为Ti,原子序数为22,其基态原子的外围电子排布式为3d24s2,故答案为:3d24s2;
(2)A、B、C形成的ABC分子为HCN,结构为H-C≡N,则含2个σ键,2个π键,故答案为:2;2;
(3)由晶胞结构可知,晶胞中Ti元素数目为1+8×
| 1 |
| 8 |
| 1 |
| 2 |
(4)同周期自左而右第一电离能增大,但N原子p轨道半满,为稳定状态,故第一电离能C<O<N,故答案为:C<O<N;
(5)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3?6H20的绿色晶体,该晶体中两配体的物质的量之比为1:5,则配体中有1个Cl-、5个H2O,2个氯离子位于外界,则该配离子的化学式为[TiCl(H2O)5]2+,故答案为:[TiCl(H2O)5]2+.
点评:本题综合性较大,涉及结构性质位置关系、元素周期律、第一电离能、核外电子排布、配合物、分子结构等,题目难度中等,是物质结构的综合性题目,是对学生综合能力的考查,推断元素是解题的关键.

练习册系列答案
相关题目
已知A、B、C、D分别是Cu、Ag、Fe、Al四种金属中的一种.已知①A、C均能与稀硫酸反应放出气体;②B与D的硝酸盐反应,置换出单质D;③C与强碱反应放出气体,由此可以推断A、B、C、D依次是( )
| A、Fe、Cu、Al、Ag | B、Al、Cu、Fe、Ag | C、Cu、Ag、Al、Fe | D、Ag、Al、Cu、Fe |

 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素. (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答: