网址:http://m.1010jiajiao.com/timu3_id_432642[举报]
普通纸张的主要成分是纤维素,在早期的纸张生产中,常采用纸张表面涂敷明矾的工艺,以填补其表面的微孔,防止墨迹扩散.请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存.经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是
(2)为了保护这些纸质文物,有人建议采取下列措施:
①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等.这样操作产生的主要问题是
②喷洒Zn(C2H5)2.Zn(C2H5)2可以与水反应生成氧化锌和乙烷.用化学(离子)方程式表示该方法生成氧化锌及防止酸性腐蚀的原理
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾.钛白粉的一种工业制法是以钛铁矿(主要成分为FeTiO3)为原料按下列过程进行的,请完成下列化学方程式:
①
| ||
②
| ||
①2NaCl+H2SO4
| 500℃ |
②Na2SO4+2C
| 1000℃ |
③Na2S+CaCO3
| 1000℃ |
完成下列计算(计算过程保留3位有效数字)
(1)假设每一步反应物的量足够,反应完全,理论上每获得1kg纯度为80%的纯碱需要氯化钠的质量是
(2)步骤②碳单质过量时也同样可以反应获得Na2S,此时所发生的反应的化学方程式是
(3)通过定性分析,勒布朗制碱法获得的纯碱含有杂质CaCO3和CaS,为了测定产品纯度,取10g样品与稀硝酸反应,硫元素全部转化成淡黄色固体,称量其质量为0.16g,另取10g样品与稀盐酸反应,得到气体(忽略气体在水中的溶解),折算为标况下,体积为2.162L,计算求出该产品中Na2CO3的纯度.
(4)若除氯化钠和碳单质的量外,其它反应物足量,反应充分,如果加入a mol氯化钠时,生成的Na2CO3为y g,电子转移数为z mol,讨论分析当氯化钠与碳的物质的量之比x的值不同时,用函数式表示y和z的值是多少.
| x | y | z |
纯碱是主要的化工原料,化学家发明了其不同的工业制法,其中法国化学家尼古拉斯·勒布朗早在1791年发明的工业合成碳酸钠的方法,简称勒布朗制碱法。该方法包括以下两个阶段:首先从原料氯化钠与浓硫酸在高温下的反应得到中间产物硫酸钠,然后通过硫酸钠与木炭和碳酸钙的反应来得到碳酸钠。各步骤反应的化学方程式如下:
2NaCl+H2SO4 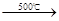 Na2SO4+2HCl↑
Na2SO4+2HCl↑
Na2SO4+2C
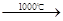 Na2S+2CO2↑
Na2S+2CO2↑
Na2S+CaCO3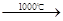 Na2CO3+CaS
Na2CO3+CaS
完成下列计算(计算过程保留3位有效数字)
(1)假设每一步反应物的量足够,反应完全,理论上每获得1kg纯度为80%的纯碱需要氯化钠的的质量是_________kg。
(2)步骤②碳单质过量时也同样可以反应获得Na2S,此时所发生的反应的化学方程式是___________________________________。若其它条件不变,步骤②按此反应进行,每获得1kg纯度为80%的纯碱需要氯化钠的的质量是__________kg,此时消耗碳单质的量是原步骤②反应用碳量的____倍。
(3)通过定性分析,勒布朗制碱法获得的纯碱含有杂质CaCO3和CaS,为了测定产品纯度,取10g样品与稀硝酸反应,硫元素全部转化成淡黄色固体,称量其质量为0.16g,另取10g样品与稀盐酸反应,得到气体(忽略气体在水中的溶解),折算为标况下,体积为2.162L,计算求出该产品中Na2CO3的纯度。
(4)若除氯化钠和碳单质的量外,其它反应物足量,反应充分, 如果加入amol氯化钠时,生成的Na2CO3为yg,电子转移数为zmol,讨论分析当氯化钠与碳的物质的量之比x的值不同时,用函数式表示y和z的值是多少。
|
x |
y |
z |
|
|
|
|
|
|
|
|
|
|
|
|
查看习题详情和答案>>
纯碱是主要的化工原料,化学家发明了其不同的工业制法,其中法国化学家尼古拉斯早在1791年发明的工业合成碳酸钠的方法,简称勒布朗制碱法.该方法包括以下两个阶段:首先从原料氯化钠与浓硫酸在高温下的反应得到中间产物硫酸钠,然后通过硫酸钠与木炭和碳酸钙的反应来得到碳酸钠.各步骤反应的化学方程式如下:
①2NaCl+H2SO4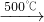 Na2SO4+2HCl↑
Na2SO4+2HCl↑
②Na2SO4+2C 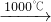 Na2S+2CO2↑
Na2S+2CO2↑
③Na2S+CaCO3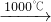 Na2CO3+CaS
Na2CO3+CaS
完成下列计算(计算过程保留3位有效数字)
(1)假设每一步反应物的量足够,反应完全,理论上每获得1kg纯度为80%的纯碱需要氯化钠的质量是______kg.
(2)步骤②碳单质过量时也同样可以反应获得Na2S,此时所发生的反应的化学方程式是______.若其它条件不变,步骤②按此反应进行,每获得1kg纯度为80%的纯碱需要氯化钠的质量是______kg,此时消耗碳单质的量是原步骤②反应用碳量的______倍.
(3)通过定性分析,勒布朗制碱法获得的纯碱含有杂质CaCO3和CaS,为了测定产品纯度,取10g样品与稀硝酸反应,硫元素全部转化成淡黄色固体,称量其质量为0.16g,另取10g样品与稀盐酸反应,得到气体(忽略气体在水中的溶解),折算为标况下,体积为2.162L,计算求出该产品中Na2CO3的纯度.
(4)若除氯化钠和碳单质的量外,其它反应物足量,反应充分,如果加入a mol氯化钠时,生成的Na2CO3为y g,电子转移数为z mol,讨论分析当氯化钠与碳的物质的量之比x的值不同时,用函数式表示y和z的值是多少.
| x | y | z |
纯碱是主要的化工原料,化学家发明了其不同的工业制法,其中法国化学家尼古拉斯·勒布朗早在1791年发明的工业合成碳酸钠的方法,简称勒布朗制碱法.该方法包括以下两个阶段:首先从原料氯化钠与浓硫酸在高温下的反应得到中间产物硫酸钠,然后通过硫酸钠与木炭和碳酸钙的反应来得到碳酸钠.各步骤反应的化学方程式如下:
①2NaCl+H2SO4![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
②Na2SO4+2C![]() Na2S+2CO2↑
Na2S+2CO2↑
③Na2S+CaCO3![]() Na2CO3+CaS
Na2CO3+CaS
完成下列计算(计算过程保留3位有效数字)
1.假设每一步反应物的量足够,反应完全,理论上每获得1 kg纯度为80%的纯碱需要氯化钠的的质量是________kg.
2.步骤②碳单质过量时也同样可以反应获得Na2S,此时所发生的反应的化学方程式是________.若其它条件不变,步骤②按此反应进行,每获得1 kg纯度为80%的纯碱需要氯化钠的的质量是________kg,此时消耗碳单质的量
是原步骤②反应用碳量的________倍.
3.通过定性分析,勒布朗制碱法获得的纯碱含有杂质CaCO3和CaS,为了测定产品纯度,取10 g样品与稀硝酸反应,硫元素全部转化成淡黄色固体,称量其质量为0.16 g,另取10 g样品与稀盐酸反应,得到气体(忽略气体在水中的溶解),折算为标况下,体积为2.162 L,计算求出该产品中Na2CO3的纯度.
4.若除氯化钠和碳单质的量外,其它反应物足量,反应充分,如果加入a mol氯化钠时,生成的Na2CO3为yg,电子转移数为z mol,讨论分析当氯化钠与碳的物质的量之比x的值不同时,用函数式表示y和z的值是多少.